В холод – темный, в жару – светлый. Как природа влияет на организм?
Ниже небольшой словарик для лучшего понимания статьи:
Генотип – весь набор генетического материала в организме.
Ген – единица наследственности, несущая информацию о определенном признаке.
Аллель – разновидность гена.
Доминантный аллель – аллель, который подавляет другой аллель в гетерозиготном (когда у организма 2 разных аллеля) состоянии. Обозначается большой латинской буквой (например, А).
Рецессивный аллель – проявляется только в гомозиготном состоянии (если оба аллеля одинаковы). Обознается маленькой латинской буквой (например, а).
Аа — гетерозигота
АА или аа — гомозигота
Составим схему брака мужчины с блодинистыми волосами (кодируется рецессивным аллелем, генотип ‐ аа) и брюнеткой (доминантный, генотип — АА) женщины.
P(родители): АА × аа
G (гаметы) : А а
F (потомство): Аа
100% темные волосы
Признак цвета волос здесь однозначен. Если у Максима генотип Аа и у Лены генотип Аа, то у каждого из них будут темные волосы. Это типичное скрещивание из школьной программы, но в жизни всё гораздо сложнее.
Если у Максима генотип Аа и у Лены генотип Аа, то у каждого из них будут темные волосы. Это типичное скрещивание из школьной программы, но в жизни всё гораздо сложнее.
Даже у особей с одинаковым генотипом может быть разный фенотип!
Экспрессивность – разница степени выраженности признака у особей с одинаковым генотипом.
В случае различной экспрессивности организмы, имеющие одинаковый генотип, обладают несколько различающимися фенотипам.
Это происходит из-за взаимодействия между генотипом и факторами окружающей среды. Генотип подчиняется факторам окружающей среды по достаточно простому механизму, который называется условное доминирование (проявление признака у гетерозигот зависит от условий внешней среды).
Например, при определенной температуре ген работает, а при другой – нет. Примером такого доминирования является окраска гималайских кроликов.
Меланин у этих кроликов синтезируется в более холодных участках кожи, из-за чего наиболее интенсивно пигментированы уши, хвост, кончики лап, нос.
Если у него полностью сбрить шерсть и приложить холодный компресс, то животное будет покрываться более темной шерстью.
Если, кролика наоборот содержать слишком жарких условиях, при которых даже кончики ушей всегда находились в тепле, то окраска будет бледной (температурочувствительный синтез меланина не пойдёт).
И здесь возникает вопрос: почему в холод шерсть темнеет, а в жару светлеет, а не наоборот? Мы ведь привыкли, что зайцы зимой светлеют, чтобы сливаться со снегом для защиты от хищников.
Но кролик — домашнее животное. Ему не нужно спасаться от хищников. Эта адаптация связана с защитой от воздействия температуры. Черный цвет тепло притягивает, что полезно в холод, а белый цвет – наоборот, что полезно в жару.
В данном случае мы имеем температурочувствительную особь и две температуры:
1. Пермиссивную температуру (при ней ген работает нормально).
2. Рестриктивную температуру (при ней ген не работает).
Рассмотрим окраску шерсти сиамских кошек. Они обладают специальным геном, который запускается при температуре 38-39°C ( нормальная температура тела кошки) и запускает трансфармацию и темный пигмент подавляется. Поэтому, как и у гималайских кроликов, кончики лап, нос, а также область вокруг глаз темнеют.
Они обладают специальным геном, который запускается при температуре 38-39°C ( нормальная температура тела кошки) и запускает трансфармацию и темный пигмент подавляется. Поэтому, как и у гималайских кроликов, кончики лап, нос, а также область вокруг глаз темнеют.
В природе всё взаимосвязано. Она прекрасно справилась с распределением признаков для лучшей выживаемости организмов. Живые организмы созданы прекрасными саморегулируюшимися системами, способными приспосабливаться к условиям окружающей среды.
Ассоциация полиморфизма rs7903146 гена TCF7L2 с низкими концентрациями аутоантител при латентном аутоиммунном диабете взрослых (LADA) | Силко
Ведение
Латентный аутоиммунный диабет взрослых (LADA) – медленно-прогрессирующее аутоиммунное заболевание [1], характеризующееся наличием аутоантител к компонентам островковых клеток и вместе с тем клинической картиной сахарного диабета 2 типа (СД2) в дебюте. Рядом авторов было выдвинуто предположение о том, что пациенты с LADA – гетерогенная популяция, в которой выделяются подгруппы с преобладанием признаков СД 1 типа (СД1) и с преобладанием признаков СД2. Данное деление также производится на основе количества и концентрации антител. Пациенты с LADA с высокой концентрацией антител имеют фенотип, схожий с пациентами с СД1: молодой возраст на момент начала заболевания, низкий уровень С-пептида натощак, что является признаком снижения функции поджелудочной железы и высокой вероятности последующей потребности в экзогенном инсулине, редко – признаки метаболического синдрома, а также наличие вариантов гаплотипов и генотипов HLA, высокоассоциированных с развитием СД1. Другая подгруппа LADA с низкой концентрацией аутоантител фенотипически больше напоминает пациентов с СД2 – старше возраст дебюта, повышенный индекс массы тела (ИМТ), дислипидемия, отсутствие высокопредрасполагающих генотипов HLA. В нескольких исследованиях были сделаны попытки выявить гетерогенность LADA, исследуя иммунные и генетические маркеры. Одним из изучаемых генов является ген TCF7L2 – ген транскрипционного фактора 7, подобного 2-му [2, 3]. Этот генетический маркер, как показано во многих исследованиях, ассоциирован с СД2 и не встречается при классическом СД1.
Данное деление также производится на основе количества и концентрации антител. Пациенты с LADA с высокой концентрацией антител имеют фенотип, схожий с пациентами с СД1: молодой возраст на момент начала заболевания, низкий уровень С-пептида натощак, что является признаком снижения функции поджелудочной железы и высокой вероятности последующей потребности в экзогенном инсулине, редко – признаки метаболического синдрома, а также наличие вариантов гаплотипов и генотипов HLA, высокоассоциированных с развитием СД1. Другая подгруппа LADA с низкой концентрацией аутоантител фенотипически больше напоминает пациентов с СД2 – старше возраст дебюта, повышенный индекс массы тела (ИМТ), дислипидемия, отсутствие высокопредрасполагающих генотипов HLA. В нескольких исследованиях были сделаны попытки выявить гетерогенность LADA, исследуя иммунные и генетические маркеры. Одним из изучаемых генов является ген TCF7L2 – ген транскрипционного фактора 7, подобного 2-му [2, 3]. Этот генетический маркер, как показано во многих исследованиях, ассоциирован с СД2 и не встречается при классическом СД1.
Ген TCF7L2 расположен в области 10q25.3. TCF7L2 является составной частью Wnt-сигнального пути [4]. С помощью этого сигнального механизма регулируются процессы развития, функциональной активности β-клеток. TCF7L2 может оказывать влияние на пролиферацию и дифференцировку β-клеток. Была продемонстрирована выраженная ассоциация полиморфизмов гена TCF7L2 – rs12255372 и rs7903146 с развитием СД2 [5, 6, 7], что не было отмечено при СД1 [8, 9].
Выполнен ряд работ по изучению ассоциации полиморфизма rs7903146 гена TCF7L2 с развитием LADA, при этом в литературе представлены противоречивые данные. В некоторых исследованиях продемонстрировано повышение у пациентов с LADA частот аллеля и генотипов полиморфизма rs7903146 гена TCF7L2, ассоциированных с СД2 [10-14]. Но в одном исследовании повышения частот аллелей и генотипов гена TCF7L2, ассоциированных с СД2, у пациентов с LADA обнаружено не было [15].
В нашем исследовании мы изучали возможную ассоциацию полиморфного маркера rs7903146 гена TCF7L2 с развитием LADA-диабета в русской популяции.
Цель
Определить в выборках больных LADA и здоровых индивидов частоты аллелей и генотипов полиморфного маркера rs7903146 гена TCF7L2, а также провести сравнительный анализ распределения аллелей и генотипов в выборках, изучить ассоциацию с развитием болезни.
Материалы и методы
Обследовано 96 пациентов (46 женщин и 50 мужчин) с различной длительностью LADA-диабета (от 1 месяца до 5 лет). Диагноз латентного аутоиммунного диабета взрослых устанавливался пациентам с дебютом заболевания в возрасте старше 30 лет, постепенным началом, наличием, по крайней мере, одного положительного аутоантитела, ассоциированного с СД, отсутствием кетонурии, нормальными значениями базальной концентрации С-пептида.
У всех обследуемых пациентов были выявлены положительные аутоантитела. Контрольную группу составили практически здоровые лица (201 человек), сопоставимые по возрасту и полу с исследуемой группой пациентов. Медиана возраста пациентов на момент постановки диагноза составила 34 года [31,0; 42,0]. Критериями включения в контрольную группу были: данные об отсутствии нарушений углеводного обмена, отсутствие отягощенной наследственности по аутоиммунным заболеваниям. Выборка была этнически однородна.
Критериями включения в контрольную группу были: данные об отсутствии нарушений углеводного обмена, отсутствие отягощенной наследственности по аутоиммунным заболеваниям. Выборка была этнически однородна.
Проведение исследования было одобрено локальным этическим комитетом ФГБУ «Эндокринологический научный центр» (протокол №17 от 24.10.2012). Все пациенты добровольно подписали информированное согласие на участие в исследовании..
Всем пациентам и здоровым лицам из группы контроля проведено типирование полиморфизма гена TCF7L2 rs7903146; методом случай-контроль выполнено исследование ассоциации rs7903146с заболеванием LADA. Наличие аллеля Т в генотипе обозначается в статье как Т+ (носитель аллеля).
Геномную ДНК выделяли из лейкоцитов периферической крови с помощью Wizard Genomic DNA (Promega Inc., USA). Концентрацию ДНК определяли с помощью BioPhotometr (Eppendorf AG, Germany). Типирование rs7903146 проводили, используя TaqMan® SNP GenotypingAssay (ThermoFisherScientific, USA) в соответствии с инструкциями производителя.
Иммунологическое исследование включало определение аутоантител к цитоплазматическим структурам β-клеток (ICA), к глутаматдекарбоксилазе (GADA), к тирозинфосфатазе (IA-2A), к транспортеру цинка – Т8 (ZnT8). Количественное определение антител осуществляли твердофазным иммуноферментным методом ELISA (Medizym anti-IA2, Medipan; Isletest-GAD ELISA, Biomerica; Isletest – ICA ELISA, Biomerica; Medizym anti-ZnT8, Medipan).
Группа LADA была разделена на 2 подгруппы по концентрации аутоантител, ассоциированных с СД. Значения GADA, ICA, IA-2A выше 20 Ед/мл расценивались как высокие [16, 17]. Значения антител ZnT8 выше 30 Ед/мл (двукратное превышение референсных значений) расценивались как высокие.
Статистическая обработка полученных данных была проведена с использованием прикладных программ STATISTICA (StatSoftInc. США, версия 8.0). Описательные статистические данные представлены в виде: медианы и интерквартильного интервала Me [25; 75] и массовой доли %. Сравнение групп по количественным признакам осуществлялось непараметрическим методом по U-критерию Манна-Уитни. Сравнение групп по качественным признакам осуществлялось непараметрическим методом с помощью таблиц сопряженности с использованием точного двустороннего критерия Фишера или критерия χ2.
Сравнение групп по качественным признакам осуществлялось непараметрическим методом с помощью таблиц сопряженности с использованием точного двустороннего критерия Фишера или критерия χ2.
Нулевой гипотезой считается предположение об отсутствии различий между группами. Распределение частот генотипов проверяли на соответствие равновесию Харди–Вайнберга. Степень ассоциации оценивали с помощью показателя соотношения шансов (odds ratio). ОR вычисляли с помощью программы «Калькулятор для расчета статистики в исследованиях «случай-контроль»»[18]. Достоверными считали различия при р<0,05. Определяли доверительный интервал для ОR (CI (95%)).
Результаты и обсуждение
При анализе распределения частот аллелей и генотипов полиморфного маркера rs7903146 гена TCF7L2 в группах LADA и здорового контроля статистически достоверных различий обнаружено не было (табл. 1).
Таблица 1
Сравнительный анализ частот аллелей и генотипов полиморфного маркера rs7903146 гена TCF7L2 у пациентов с LADA и в контрольной группе
Аллели и генотипы | Частота аллелей и генотипов | Значение χ2 | Уровень значимости р | OR | ||
LADA, n=96 | Контроль, n=201 | значение | CI 95% | |||
Аллель С | 0,682 | 0,724 | 1,09 | 0,3 | 0,82 | 0,56–1,19 |
Аллель Т | 0,318 | 0,276 | 1,22 | 0,84–1,77 | ||
Генотип С/С | 46 (0,479) | 106 (0,527) | 1,20 | 0,55 | 0,82 | 0,51–1,34 |
Генотип С/Т | 39 (0,406) | 79 (0,393) | 1,06 | 0,64–1,74 | ||
Генотип Т/Т | 11 (0,115) | 16 (0,080) | 1,50 | 0,67–3,36 | ||
Стратификация группы LADА на две подгруппы позволила выявить значимые различия. 35 человек с LADA-диабетом имели низкие концентрации одного или нескольких аутоантител (АТ), 61 – высокие концентрации.
35 человек с LADA-диабетом имели низкие концентрации одного или нескольких аутоантител (АТ), 61 – высокие концентрации.
В группе LADА с низкими концентрациями АТ по сравнению с группой LADA с высокими концентрациями аллель Т (р=0,03; OR=1,99; CI (95%)=1,07–3,71) и генотип Т+ (р=0,04; OR=2,41; CI (95%)=1,02–5,71) встречались чаще. Данные представлены в табл. 2.
Таблица 2
Сравнительный анализ частот аллелей и генотипов полиморфного маркера rs7903146 гена TCF7L2 у пациентов c LADA с низкими и высокими концентрациями аутоантител, ассоциированными с развитием аутоиммунного СД
Аллели и генотипы | Частота аллелей и генотипов | Значение χ2 | Уровень значимости р | OR | ||
LADA-низкие АТ* (n=35) | LADA-высокие АТ** (n=61) | значение | CI 95% | |||
Аллель С | 0,586 | 0,738 | 4,74 | 0,03 | 0,50 | 0,27–0,94 |
Аллель Т | 0,414 | 0,262 | 1,99 | 1,07–3,71 | ||
Генотип С/С | 12 (0,343) | 34 (0,557) | 4,55 | 0,1 | 0,41 | 0,18–0,98 |
Генотип С/Т | 17 (0,486) | 22 (0,361) | 1,67 | 0,72–3,89 | ||
Генотип Т/Т | 6 (0,171) | 5 (0,082) | 2,32 | 0,65–8,24 | ||
Генотип С/С | 0,343 | 0,557 | 4,10 | 0,04 | 0,41 | 0,18–0,98 |
Генотип С/Т + Т/Т (Т+) | 0,657 | 0,443 | 2,41 | 1,02–5,71 | ||
*LADA-низкие АТ – наличие у пациента низких концентраций одного или нескольких аутоантител; ** LADA- высокие АТ – наличие у пациента высоких концентраций аутоантител, ассоциированных с СД
При анализе распределения частот аллелей и генотипов rs7903146 гена TCF7L2 в группах LADA с низкими концентрациями АТ и здорового контроля аллель Т и генотип Т+ (р=0,02; OR=1,85; CI (95%)=1,10–3,13 и р=0,04; OR=2,14; CI (95%)=1,01–4,53 для Т-аллеля и Т+генотипа соответственно) также чаще встречались в группе LADA с низкими концентрациями АТ.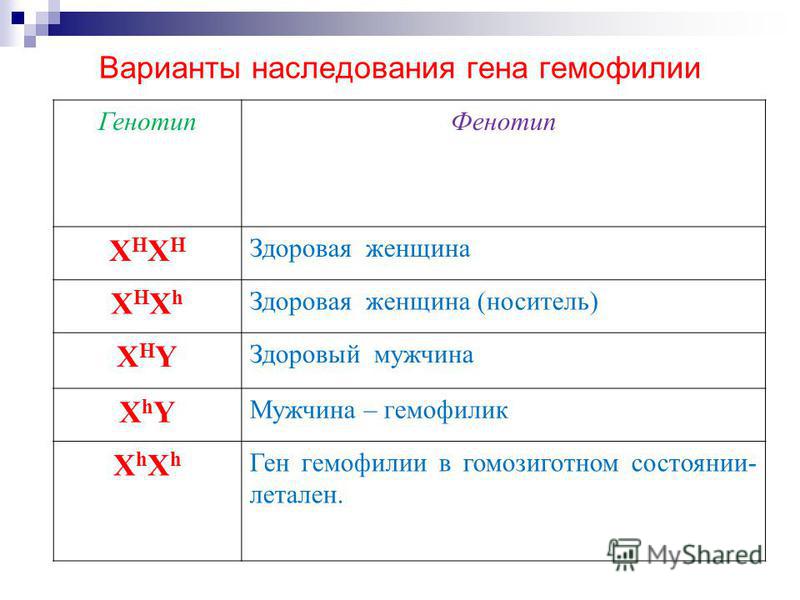 Данные представлены в табл. 3.
Данные представлены в табл. 3.
Таблица 3
Сравнительный анализ частот аллелей и генотипов полиморфного маркера rs7903146 гена TCF7L2 у пациентов c LADA с низкими концентрациями аутоантител, ассоциированными с развитием аутоиммунного СД, и в контрольной группе
Аллели и генотипы | Частота аллелей и генотипов | Значение χ2 | Уровень значимости р | OR | ||
LADA-низкие АТ* (n=35) | Контроль, n=201 | значение | CI 95% | |||
Аллель С | 0,586 | 0,724 | 5,46 | 0,02 | 0,54 | 0,32–0,91 |
Аллель Т | 0,414 | 0,276 | 1,85 | 1,10–3,13 | ||
Генотип С/С | 12 (0,343) | 106 (0,527) | 5,36 | 0,07 | 0,47 | 0,22–0,99 |
Генотип С/Т | 17 (0,486) | 79 (0,393) | 1,46 | 0,71–3,00 | ||
Генотип Т/Т | 6 (0,171) | 16 (0,080) | 2,39 | 0,87–6,61 | ||
Генотип С/С | 0,343 | 0,527 | 4,06 | 0,04 | 0,47 | 0,22–0,99 |
Генотип С/Т + Т/Т (Т+) | 0,657 | 0,473 | 2,14 | 1,01–4,53 | ||
*LADA-низкие АТ – наличие у пациента низких концентраций одного или нескольких аутоантител
Распределение частот аллелей и генотипов rs7903146 TCF7L2 в группе LADA с высокими концентрациями АТ и группе контроля значимо не отличались (р=0,76 для аллелей и р=0,9 для генотипов).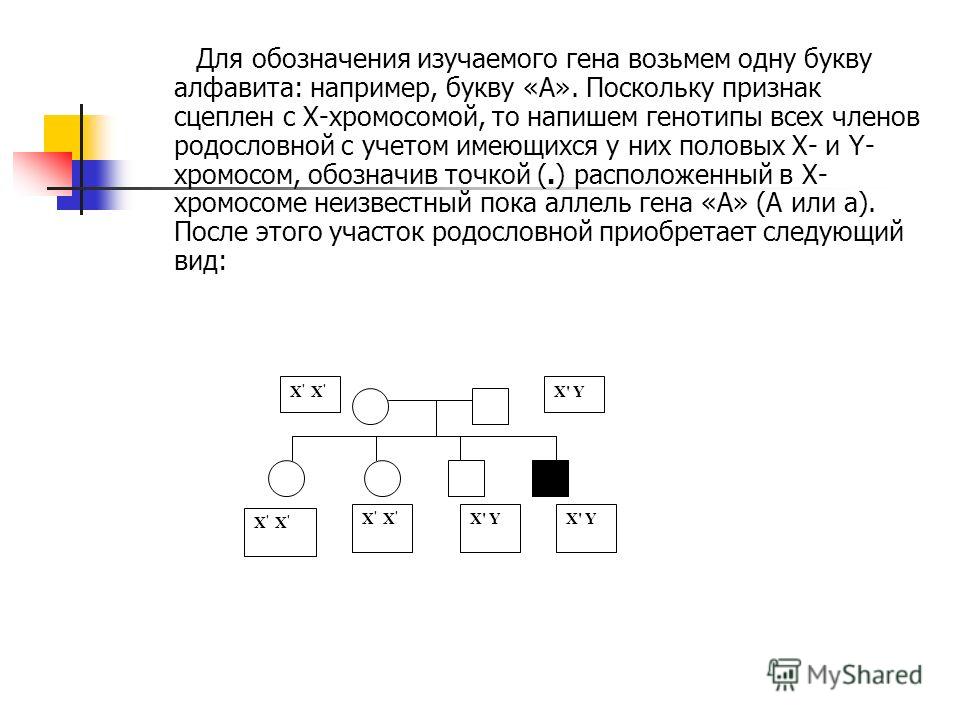
Таким образом, установлена ассоциация аллеля Т и генотипа Т+ с LADA-диабетом с низкими концентрациями АТ.
Обсуждение
СД1 и СД2 являются заболеваниями с полигенным наследованием. Наибольшее значение из известных генетических маркеров СД1 имеют гены, расположенные в области главного комплекса гистосовместимости (HLA). Считается, что LADA – это вариант СД1 с медленным прогрессированием. Это подтверждают исследования по изучению роли HLA при LADA, так, установлена ассоциация HLA класса II с развитием как LADA, так и СД1 [19, 20]. При этом наличие, как правило, только одного предрасполагающего гаплотипа в сочетании с протективным или нейтральным в генотипе больных LADA, вероятно, обуславливает менее агрессивное течение заболевания [21]. Ситуация изменилась с обнаружением ассоциации между полиморфизмами генаTCF7L2 и СД2 и ее отсутствием при СД1 [5–7]. Повышение частоты ассоциированных с СД2 генотипов обнаружено также у пациентов с LADA [10]. Было выдвинуто предположение, что LADA – это «гибридная» форма СД, а не просто частный случай СД1. Состоялись исследования по изучению ассоциации вариантов гена TCF7L2 при LADA, при этом в литературе представлены противоречивые данные. Cervin C с коллегами обнаружили у пациентов с LADA, как и у больных с СД2, повышение частот СТ/ТТ генотипов rs7903146 гена TCF7L2 (52,8%,р=0,03 и 54,1%, р=3х10-7 для LADA и СД2 соответственно) по сравнению с группой контроля (44,8%) и пациентами с СД1 (43,3%) [10]. В другом исследовании была установлена ассоциация Т-аллеля с развитием СД2 и LADA. Носители Т-аллеля имели более низкий ИМТ [11]. Другими авторами была обнаружена ассоциация ТТ-генотипа с LADA-диабетом (15% против 6%, р=0,03;OR=2,81, CI (95%)=1,11–7,23). У лиц с предрасполагающим генотипом были отмечены более низкие значения базального С-пептида (p<0,01) [12]. Zampetti S с соавт. описали у больных LADA с низким титром антител GADA и пациентов с СД2 повышение частот СТ/ТТ генотипов по сравнению с больными LADA с высоким титром GADA, больными СД1 и группой контроля (р≤0,04 для всех сравнений).
Состоялись исследования по изучению ассоциации вариантов гена TCF7L2 при LADA, при этом в литературе представлены противоречивые данные. Cervin C с коллегами обнаружили у пациентов с LADA, как и у больных с СД2, повышение частот СТ/ТТ генотипов rs7903146 гена TCF7L2 (52,8%,р=0,03 и 54,1%, р=3х10-7 для LADA и СД2 соответственно) по сравнению с группой контроля (44,8%) и пациентами с СД1 (43,3%) [10]. В другом исследовании была установлена ассоциация Т-аллеля с развитием СД2 и LADA. Носители Т-аллеля имели более низкий ИМТ [11]. Другими авторами была обнаружена ассоциация ТТ-генотипа с LADA-диабетом (15% против 6%, р=0,03;OR=2,81, CI (95%)=1,11–7,23). У лиц с предрасполагающим генотипом были отмечены более низкие значения базального С-пептида (p<0,01) [12]. Zampetti S с соавт. описали у больных LADA с низким титром антител GADA и пациентов с СД2 повышение частот СТ/ТТ генотипов по сравнению с больными LADA с высоким титром GADA, больными СД1 и группой контроля (р≤0,04 для всех сравнений). У больных LADA-диабетом с низким титром антител GADA, а также у пациентов с СД2 отмечено повышение частоты Т-аллеля [13]. Bakhtadze E с соавт. указывают на увеличение частот генотипов СТ/ТТ у лиц с СД в возрасте от 15 до 34 лет с отрицательными антителами к GAD по сравнению с GADA-положительными пациентами (53% против 43%, р=0,0004) [14]. Тем не менее, по результатам одного из исследований ассоциация между полиморфизмом rs7903146 гена TCF7L2 и LADA не была установлена [16]. Многие исследователи не обнаружили подобной ассоциации гена TCF7L2 с СД1 [8, 9]. Однако Redondo MJ с соавторами в своей работе по изучению ассоциации вариантов TCF7L2 у детей с СД1 описывают следующее распределение генотипов: для пациентов с одним положительным АТ, n=15 – СС 40%, СТ 26,7%, ТТ 33,3%; для пациентов с ≥2 АТ соответственно, n=56 – СС 50%, СТ 42,9%, ТТ 7,1%, р=0,024 [22].
У больных LADA-диабетом с низким титром антител GADA, а также у пациентов с СД2 отмечено повышение частоты Т-аллеля [13]. Bakhtadze E с соавт. указывают на увеличение частот генотипов СТ/ТТ у лиц с СД в возрасте от 15 до 34 лет с отрицательными антителами к GAD по сравнению с GADA-положительными пациентами (53% против 43%, р=0,0004) [14]. Тем не менее, по результатам одного из исследований ассоциация между полиморфизмом rs7903146 гена TCF7L2 и LADA не была установлена [16]. Многие исследователи не обнаружили подобной ассоциации гена TCF7L2 с СД1 [8, 9]. Однако Redondo MJ с соавторами в своей работе по изучению ассоциации вариантов TCF7L2 у детей с СД1 описывают следующее распределение генотипов: для пациентов с одним положительным АТ, n=15 – СС 40%, СТ 26,7%, ТТ 33,3%; для пациентов с ≥2 АТ соответственно, n=56 – СС 50%, СТ 42,9%, ТТ 7,1%, р=0,024 [22].
В нашем исследовании стратификация группы LADA на две подгруппы по уровню аутоантител позволила выявить статистически значимые различия в распределении частот аллелей и генотипов маркера rs7903146 гена TCF7L2 в группе LADA с низкими концентрациями аутоантител по сравнению с группой с высокими концентрациями и с группой контроля. Установлена ассоциация аллеля Т и генотипа Т+ с LADA-диабетом с низкими концентрациями АТ.
Установлена ассоциация аллеля Т и генотипа Т+ с LADA-диабетом с низкими концентрациями АТ.
Таким образом, результаты исследования позволяют предполагать, что группа пациентов с LADA с низкими концентрациями аутоантител имеет генетически обусловленное сходство с СД2. LADA является не только гетерогенной, но и «гибридной» формой диабета, сочетающей не только клинические проявления СД1 и СД2, но и их генетические маркеры. Исследование в русской популяции проведено впервые.
Поскольку исследование проведено на небольшой выборке больных, полученные данные требуют дальнейшего анализа.
Дополнительная информация
Информация о финансировании
Финансирование осуществлялось в рамках научной программы ФГБУ «Эндокринологический научный центр»: «Геномные, постгеномные и протеомные технологии в изучении механизмов развития сахарного диабета и его осложнений».
Информация о финансировании и конфликте интересов
Данная работа является частью диссертационного исследования аспиранта ФГБУ «Эндокринологический научный центр» Силко Ю. В., научный руководитель – д.м.н. Никонова Т.В. Авторы декларируют отсутствие иных явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи, о которых необходимо сообщить.
В., научный руководитель – д.м.н. Никонова Т.В. Авторы декларируют отсутствие иных явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи, о которых необходимо сообщить.
Участие авторов: Дедов И.И. – утверждение концепции и дизайна исследования; окончательная проверка и правка текста рукописи; Шестакова М.В. – непосредственное руководство научным исследованием, научная редактура рукописи; Никонова Т.В. – разработка концепции и дизайна исследования, интерпретация результатов исследования, проверка и правка текста рукописи; Иванова О.Н. – выполнение лабораторных исследований, проверка и правка текста рукописи; Силко Ю.В. – сбор клинического материала, проведение проб, статистическая обработка результатов исследования, интерпретация результатов, написание текста рукописи; Степанова С.М. – выполнение лабораторных исследований, интерпретация результатов.
1. Leslie RD, Palmer J, Schloot NC, Lernmark A. Diabetes at the crossroads: relevance of disease classification to pathophysiology and treatment. Diabetologia. 2016;59(1):13-20. doi: 10.1007/s00125-015-3789-z
Diabetologia. 2016;59(1):13-20. doi: 10.1007/s00125-015-3789-z
2. Tuomi T, Santoro N, Caprio S, et al. The many faces of diabetes: a disease with increasing heterogeneity. The Lancet. 2014;383(9922):1084-1094. doi: 10.1016/s0140-6736(13)62219-9
3. Grant SF, Hakonarson H, Schwartz S. Can the genetics of type 1 and type 2 diabetes shed light on the genetics of latent autoimmune diabetes in adults? Endocr Rev. 2010;31(2):183-193. doi: 10.1210/er.2009-0029
4. Wagner R, Staiger H, Ullrich S, et al. Untangling the interplay of genetic and metabolic influences on beta-cell function: Examples of potential therapeutic implications involving TCF7L2 and FFAR1.Molecular Metabolism. 2014;3(3):261-267. doi: http://dx.doi.org/10.1016/j.molmet.2014.01.001
5. Tong Y, Lin Y, Zhang Y, et al. Association between TCF7L2gene polymorphisms and susceptibility to Type 2 Diabetes Mellitus: a large Human Genome Epidemiology (HuGE) review and meta-analysis.BMC Medical Genetics. 2009;10(1). doi: 10.1186/1471-2350-10-15
doi: 10.1186/1471-2350-10-15
6. Assmann TS, Duarte GC, Rheinheimer J, et al. The TCF7L2 rs7903146 (C/T) polymorphism is associated with risk to type 2 diabetes mellitus in Southern-Brazil. Arq Bras Endocrinol Metabol.2014;58(9):918-925. doi: 10.1590/0004-2730000003510
7. Wang J, Zhang J, Li L, et al. Association of rs12255372 in the TCF7L2 gene with type 2 diabetes mellitus: a meta-analysis. Brazilian Journal of Medical and Biological Research. 2013;46(4):382-393. doi: 10.1590/1414-431×20132677
8. Raj SM, Howson JM, Walker NM, et al. No association of multiple type 2 diabetes loci with type 1 diabetes. Diabetologia. 2009;52(10):2109-2116. doi: 10.1007/s00125-009-1391-y
9. Basile KJ, Guy VC, Schwartz S, Grant SF. Overlap of genetic susceptibility to type 1 diabetes, type 2 diabetes, and latent autoimmune diabetes in adults. Curr Diab Rep. 2014;14(11):550. doi: 10.1007/s11892-014-0550-9
10. Cervin C, Lyssenko V, Bakhtadze E, et al. Genetic similarities between latent autoimmune diabetes in adults, type 1 diabetes, and type 2 diabetes. Diabetes. 2008;57(5):1433-1437. doi: 10.2337/db07-0299
Diabetes. 2008;57(5):1433-1437. doi: 10.2337/db07-0299
11. Lukacs K, Hosszufalusi N, Dinya E, et al. The type 2 diabetes-associated variant in TCF7L2 is associated with latent autoimmune diabetes in adult Europeans and the gene effect is modified by obesity: a meta-analysis and an individual study. Diabetologia. 2012;55(3):689-693. doi: 10.1007/s00125-011-2378-z
12. Szepietowska B, Moczulski D, Wawrusiewicz-Kurylonek N, et al. Transcription factor 7-like 2-gene polymorphism is related to fasting C peptide in latent autoimmune diabetes in adults (LADA). Acta Diabetol. 2010;47(1):83-86. doi: 10.1007/s00592-009-0133-4
13. Zampetti S, Spoletini M, Petrone A, et al. Association of TCF7L2 gene variants with low GAD autoantibody titre in LADA subjects (NIRAD Study 5). Diabet Med. 2010;27(6):701-704. doi: 10.1111/j.1464-5491.2010.02997.x
14. Bakhtadze E, Cervin C, Lindholm E, et al. Common variants in the TCF7L2 gene help to differentiate autoimmune from non-autoimmune diabetes in young (15-34 years) but not in middle-aged (40-59 years) diabetic patients. Diabetologia. 2008;51(12):2224-2232. doi: 10.1007/s00125-008-1161-2
Diabetologia. 2008;51(12):2224-2232. doi: 10.1007/s00125-008-1161-2
15. Pettersen E, Skorpen F, Kvaloy K, et al. Genetic heterogeneity in latent autoimmune diabetes is linked to various degrees of autoimmune activity: results from the Nord-Trondelag Health Study. Diabetes.2010;59(1):302-310. doi: 10.2337/db09-0923
16. Lohmann T, Kellner K, Verlohren HJ, et al. Titre and combination of ICA and autoantibodies to glutamic acid decarboxylase discriminate two clinically distinct types of latent autoimmune diabetes in adults (LADA). Diabetologia. 2001;44(8):1005-1010. doi: 10.1007/s001250100602
17. Rosário PWS, Reis JS, Fagundes TA, et al. Latent autoimmune diabetes in adults (LADA): usefulness of anti-GAD antibody titers and benefit of early insulinization. ArqBras Endocrinol Metabol.2007;51(1):52-58. doi: 10.1590/s0004-27302007000100009
18. Калькулятор для расчета статистики в исследованиях «случай-контроль». [Kal’kulyator dlya rascheta statistiki v issledovaniyakh «sluchay-kontrol’». (in Russ)]. Available from: http://gen-exp.ru/ calculator_or.php.
(in Russ)]. Available from: http://gen-exp.ru/ calculator_or.php.
19. Laugesen E, Ostergaard JA, Leslie RD, et al. Latent autoimmune diabetes of the adult: current knowledge and uncertainty. Diabet Med. 2015;32(7):843-852. doi: 10.1111/dme.12700
20. Дедов И.И., Шестакова М.В., Кураева Т.Л., и др. Нозологическая гетерогенность, молекулярная генетика и иммунология аутоиммунного сахарного диабета. // Вестник РАМН. – 2015. – Т. 70. — №2 – С. 132-138. [Dedov II, Shestakova MV, Kuraeva TL, et al. Nozological Heterogeneity, Molecular Genetics and Immunology of Autoimmune Diabetes Mellitus. Annals of the Russian academy of medical sciences. 2015;70(2):132-138. (in Russ)].
21. Никонова Т.В., Апанович П.В., Пекарева Е.В., и др. Иммуногенетические аспекты медленно прогрессирующего аутоимунного диабета у взрослых (LADA) // Сахарный диабет. — 2011. — Т. 14. — №1 — C. 28-34. [Nikonova TV, Apanovich PV, Pekareva EV, Gorelysheva VA, Stepanova SM, Tishina YV, et al. Immunogenetic characteristics of LADA. Diabetes mellitus. 2011;14(1):28-34. (in Russ)]. doi: 10.14341/2072-0351-6247
Diabetes mellitus. 2011;14(1):28-34. (in Russ)]. doi: 10.14341/2072-0351-6247
22. Redondo MJ, Muniz J, Rodriguez LM, et al. Association of TCF7L2 variation with single islet autoantibody expression in children with type 1 diabetes. BMJ Open Diabetes Res Care. 2014;2(1):e000008. doi: 10.1136/bmjdrc-2013-000008
Что на самом деле означает «+»?
By Джим Йидон, доктор философии.
Сообщение в блоге
Во многих наших презентациях и вебинарах JAX мы широко обсуждаем правила и нюансы номенклатуры штаммов и генов, но очень мало упоминаем о том, как следует обозначать/символизировать генотипы отдельных животных. В этом посте я хотел бы исправить эту оплошность.
Насколько мне известно, не существует санкционированных комитетом правил, применимых к определению генотипов мышей. Таким образом, те, которые я описываю ниже, являются именно теми, которые я и мои коллеги из группы JAX Technical Information Services (TIS) обычно используем при обсуждении наших мышей. (ВНИМАНИЕ! Я не обещаю вам, что наши обозначения генотипов будут иметь смысл, я только объясню их!)
(ВНИМАНИЕ! Я не обещаю вам, что наши обозначения генотипов будут иметь смысл, я только объясню их!)
Во-первых, мы всегда используем символ «+» для обозначения аллеля дикого типа или немодифицированного типа, описываемого напряжения. Для спонтанно или целенаправленно мутантных мышей это обозначение имеет смысл: «+» указывает на аллель дикого типа, а «-» — на мутантный аллель. Таким образом, мы обозначаем генотипы наших мышей «-/-» для гомозиготных мутантов, «+/-» для гетерозигот и «+/+» для диких типов. Пока что довольно просто, я думаю.
Для условных целевых мутаций, содержащих loxP, и «knockin» мутантный аллель часто обозначается с использованием «floxed», «flox» или «fl» для первого и аббревиатуры любой последовательности, вставленной в локус (например, cre, lacZ, EGFP и т. д.) для последнего; следовательно, генотипы для гомозигот и гетерозигот становятся, например, «fl/fl» и «fl/+» или «cre/cre» и «cre/+» соответственно.
С трансгенными мышами мы используем немного другое соглашение.
Во избежание такой путаницы группа Службы технической информации JAX обычно использует «Tg» для обозначения трансгенных аллелей. Это позволяет нам использовать «Tg/Tg» для обозначения гомозиготных трансгенных мышей и по-прежнему использовать «+/+» для обозначения нетрансгенных мышей дикого типа. Отсюда следует, что мы должны использовать «Tg/+» для обозначения гемизиготных трансгенных мышей, верно? Ну, на самом деле, нет. Поскольку трансгены представляют собой дополнительные фрагменты ДНК в геноме мыши, которые не имеют соответствующей последовательности «дикого типа» в немодифицированном геноме, мы записываем генотипы гемизиготных мышей как «Tg/0».
Как я уже говорил ранее, не существует жестких и быстрых правил для обозначения генотипов мышей, и вы вольны выбирать любые соглашения, которые вам нравятся. Какие бы термины вы ни использовали для обозначения своих генотипов, я призываю вас предоставить какой-то ключ или систему отсчета, чтобы исследователи, которые читают ваши статьи, и коллеги, которым приходится читать карты клеток ваших животных, могли легко определить, какие генотипы к каким относятся. Если кто-то из вас использует другие соглашения, я хотел бы услышать о них!
генотип
Генотип описывает генетическую конституцию индивидуума, то есть специфический аллельный состав индивидуума, обычно со ссылкой на рассматриваемый специфический признак [1] . Например, существует три возможных генотипа гена альбиноса человека, и он имеет две аллельные формы: доминантную А и рецессивную а. Таким образом, тремя возможными генотипами являются АА (гомозиготный доминантный), Аа (гетерозиготный) и аа (гомозиготный рецессивный).
Например, существует три возможных генотипа гена альбиноса человека, и он имеет две аллельные формы: доминантную А и рецессивную а. Таким образом, тремя возможными генотипами являются АА (гомозиготный доминантный), Аа (гетерозиготный) и аа (гомозиготный рецессивный).
Общепринятая теория заключается в том, что наследственный генотип, передаваемые эпигенетические факторы и ненаследственная изменчивость окружающей среды способствуют формированию фенотипа индивидуума.
Ненаследственные мутации ДНК классически не понимаются как представляющие генотип индивидуума. Поэтому ученые и врачи иногда говорят, например, о (гено)типе конкретного рака, то есть о генотипе болезни в отличие от больного.
Дополнительные рекомендуемые знания
Содержимое
|
Генотип и геномная последовательность
Основная статья: Геном
Генотип незначительно отличается от последовательности генома.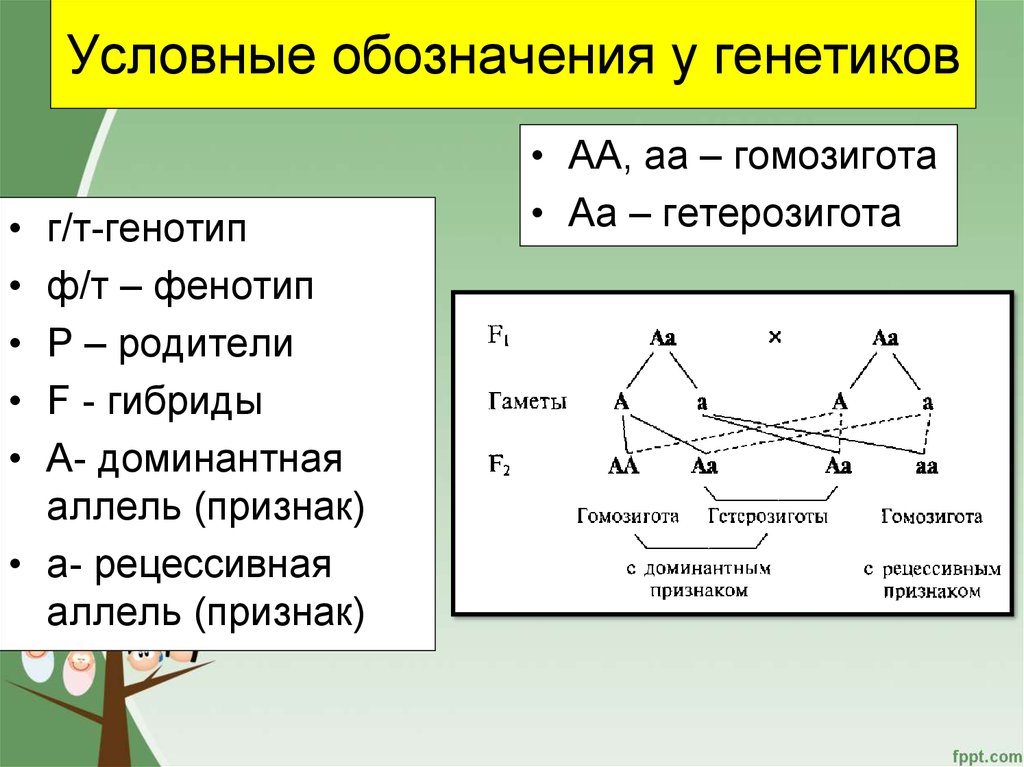 Последовательность — это абсолютная мера основного состава индивидуума, представителя вида или группы; генотип обычно подразумевает измерение того, насколько особь отличается от или специализирована внутри группы особей или вида. Таким образом, как правило, один относится к генотипу человека в отношении конкретного интересующего гена, а у полиплоидных людей это относится к тому, какую комбинацию аллелей несет человек (см. гомозиготные, гетерозиготные).
Последовательность — это абсолютная мера основного состава индивидуума, представителя вида или группы; генотип обычно подразумевает измерение того, насколько особь отличается от или специализирована внутри группы особей или вида. Таким образом, как правило, один относится к генотипу человека в отношении конкретного интересующего гена, а у полиплоидных людей это относится к тому, какую комбинацию аллелей несет человек (см. гомозиготные, гетерозиготные).
Генотип и фенотип
Основная статья: Фенотип
Любой данный ген обычно вызывает наблюдаемое изменение в организме, известное как фенотип. Термины генотип и фенотип различаются по крайней мере по двум причинам:
- Различать источник знаний наблюдателя (можно узнать о генотипе, наблюдая за ДНК; о фенотипе можно узнать, наблюдая за внешним видом организма).
- Генотип и фенотип не всегда напрямую связаны. Некоторые гены проявляют данный фенотип только в определенных условиях окружающей среды.
 И наоборот, некоторые фенотипы могут быть результатом множественных генотипов. Генотип обычно смешивают с фенотипом, который описывает конечный результат как генетических факторов, так и факторов окружающей среды, приводящих к наблюдаемому выражению (например, голубые глаза, цвет волос или различные наследственные заболевания).
И наоборот, некоторые фенотипы могут быть результатом множественных генотипов. Генотип обычно смешивают с фенотипом, который описывает конечный результат как генетических факторов, так и факторов окружающей среды, приводящих к наблюдаемому выражению (например, голубые глаза, цвет волос или различные наследственные заболевания).
Простым примером, иллюстрирующим отличие генотипа от фенотипа, является окраска цветков гороха (см. Грегор Мендель). Существует три доступных генотипа: PP (гомозиготный доминантный), Pp (гетерозиготный) и pp (гомозиготный рецессивный). Все три имеют разные генотипы, но первые два имеют одинаковый фенотип (фиолетовый), в отличие от третьего (белый).
Более техническим примером для иллюстрации генотипа является однонуклеотидный полиморфизм или SNP. SNP возникает, когда соответствующие последовательности ДНК разных людей различаются по одному основанию ДНК, например, когда последовательность AAGCCTA меняется на AAGCTTA. Он содержит два аллеля : C и T.
Генотип и менделевское наследование
Основная статья: Менделевское наследование
Различие между генотипом и фенотипом обычно наблюдается при изучении семейных моделей некоторых наследственных заболеваний или состояний, например, гемофилии. Из-за диплоидности человека (и большинства животных) для любого данного гена существует два аллеля. Эти аллели могут быть одинаковыми (гомозиготными) или разными (гетерозиготными), в зависимости от индивидуума (см. зигота). При доминантном аллеле потомство гарантированно наследует рассматриваемый признак независимо от второго аллеля. При рецессивном аллеле фенотип зависит от другого аллеля. В случае гемофилии и аналогичных рецессивных заболеваний гетерозиготным индивидуумом является
 У этого человека нормальный фенотип, но риск передачи его или ее аномального гена потомству равен 50 на 50. Гомозиготная рецессивная особь имеет нормальный фенотип и не имеет риска аномального потомства. Гомозиготная доминантная особь имеет аномальный фенотип и гарантированно передает аномальный ген потомству.
У этого человека нормальный фенотип, но риск передачи его или ее аномального гена потомству равен 50 на 50. Гомозиготная рецессивная особь имеет нормальный фенотип и не имеет риска аномального потомства. Гомозиготная доминантная особь имеет аномальный фенотип и гарантированно передает аномальный ген потомству.Генотип и генетика
Основная статья: Генетика
При тщательном планировании эксперимента можно использовать статистические методы для корреляции различий в генотипах популяций с различиями в их наблюдаемом фенотипе. Эти исследования генетической ассоциации могут быть использованы для определения генетических факторов риска, связанных с заболеванием. Они могут даже быть в состоянии различать группы населения, которые могут или не могут положительно реагировать на конкретное медикаментозное лечение. Такой подход известен как персонализированная медицина или фармакогенетика.
Генотип и математика
- Основные статьи: Генетическое программирование и эволюционный алгоритм
Вдохновленные биологической концепцией и полезностью генотипов, информатика использует смоделированные генотипы в генетическом программировании и эволюционных алгоритмах. Такие методы могут помочь разработать математические решения для определенных типов сложных задач.
Такие методы могут помочь разработать математические решения для определенных типов сложных задач.
Определение генотипа
Основная статья: Генотипирование
Генотипирование — это процесс установления генотипа индивидуума с помощью биологического анализа. Методы, также известные как генотипический анализ , включают ПЦР, анализ фрагментов ДНК, секвенирование и гибридизацию нуклеиновых кислот с микрочипами или гранулами. Несколько распространенных методов генотипирования включают полиморфизм длин рестрикционных фрагментов (

 И наоборот, некоторые фенотипы могут быть результатом множественных генотипов. Генотип обычно смешивают с фенотипом, который описывает конечный результат как генетических факторов, так и факторов окружающей среды, приводящих к наблюдаемому выражению (например, голубые глаза, цвет волос или различные наследственные заболевания).
И наоборот, некоторые фенотипы могут быть результатом множественных генотипов. Генотип обычно смешивают с фенотипом, который описывает конечный результат как генетических факторов, так и факторов окружающей среды, приводящих к наблюдаемому выражению (например, голубые глаза, цвет волос или различные наследственные заболевания).