ГЕНОТИП | это… Что такое ГЕНОТИП?
ГЕНОТИП(от ген и греч. typos — отпечаток), генетич. (наследственная) конституция организма, совокупность всех наследственных задатков данной клетки или организма, включая аллели генов, характер их физич. сцепления в хромосомах и наличие хромосомных перестроек. В узком смысле Г.— совокупность аллелей гена или группы генов, контролирующих анализируемый признак у данного организма (в этом случае нерассматриваемая часть Г. выступает в качестве генотипической среды). Термин «Г.» предложен В. Иогапсеном в 1909. В совр. генетике Г. рассматривают не как меха-пич. набор независимо функционирующих генов (что было характерно для ранних этапов развития генетики), а как единую систему генетич. элементов, взаимодействующих на разл. уровнях (напр.. между аллелями одного гена или разных генов). Г. контролирует развитие, строение и жизнедеятельность организма, т.е. совокупность всех признаков организма — его фенотип. Особи с разными Г. могут иметь одинаковый фенотип, поэтому для определения Г.
 процесса. Наличие особей одинакового Г. характерно для видов с бесполым (включая вегетативное) способом размножения и для чистых линий. Одинаковым Г. обладают идентичные (однояйцевые) близнецы, развивающиеся из одной оплодотворённой яйцеклетки.
процесса. Наличие особей одинакового Г. характерно для видов с бесполым (включая вегетативное) способом размножения и для чистых линий. Одинаковым Г. обладают идентичные (однояйцевые) близнецы, развивающиеся из одной оплодотворённой яйцеклетки..(Источник: «Биологический энциклопедический словарь.» Гл. ред. М. С. Гиляров; Редкол.: А. А. Бабаев, Г. Г. Винберг, Г. А. Заварзин и др. — 2-е изд., исправл. — М.: Сов. Энциклопедия, 1986.)
геноти́пвсе гены организма, в совокупности определяющие все признаки организма – его фенотип. Если геном есть генетическая характеристика вида, то генотип является генетической характеристикой (конституцией) конкретного организма. При изучении наследования определённых признаков генотипом называют не все гены, а только те, которые эти признаки определяют.
Генотип представляет собой не механическую сумму автономных, независимо действующих генов, а сложную и целостную систему – генотипическую среду, в которой работа и реализация каждого гена зависят от влияния других генов.
При взаимодействии неаллельных генов возможны комплементарность (взаимодополняемость генов) и эпистаз (подавление одним геном другого). Эти формы взаимодействия относятся к качественным признакам. Степень развития многих т.н. количественных признаков (к ним относятся, напр., высота растений, масса и рост животных, жирность молока, яйценоскость кур и другие хозяйственно ценные свойства) зависит от совместного действия ряда неаллельных доминантных генов. Это явление называется полимерией, а гены, действующие в одном направлении, – полимерными генами. Обратное явление, когда один ген влияет на развитие нескольких признаков, называется плейотропией. В основе всех этих проявлений генотипической среды лежит то обстоятельство, что развитие любого признака происходит в результате целого ряда последовательных биохимических реакций, каждая из которых контролируется отдельным геном.

Особи с одинаковым генотипом, развивающиеся в разных условиях внешней среды, могут иметь различные фенотипы. В связи с этим в генетике было разработано представление о норме реакции, т.е. о тех границах, в пределах которых под влиянием разных условий среды может изменяться фенотип при данном генотипе. Таким образом, размах фенотипической изменчивости тоже определяется генотипом, или, другими словами, фенотип есть результат взаимодействия генотипа и внешней среды. Получение клеток и особей с одинаковым генотипом путём вегетативного размножения и
.(Источник: «Биология. Современная иллюстрированная энциклопедия.» Гл. ред. А. П. Горкин; М.: Росмэн, 2006.)
Анализ крови на ВПЧ и рак шейки матки, кольпоскопия цена- CMD
Вирус папилломы человека (ВПЧ) — ДНК-содержащий вирус семейства Papillomaviridae. В это семейство входят распространенные и генетически разнообразные вирусы, инфицирующие и поражающие клетки эпителия (кожа, слизистые аногенитальной области, ротовой полости).
Известно более 130 генотипов ВПЧ. По клинической классификации их делят на кожные и аногенитальные типы папилломавирусов. Именно аногенитальные типы ВПЧ вызывают поражения слизистых оболочек влагалища и шейки матки. Самые безобидные из этих заболеваний — доброкачественные остроконечные кондиломы половых органов, самое опасное — рак шейки матки.
Передаются вирусы папилломы человека при половых контактах. С началом половой жизни этим вирусом заражается подавляющее большинство женщин. Следует учитывать, что риск заражения ВПЧ зависит и от количества половых партнёров и от сексуального поведения единственного партнёра (распространенность ВПЧ у мужчин примерно равна распространенности среди женщин).
Сама по себе папилломавирусная инфекция — не заболевание. Через 6-18 месяцев у ~80% инфицированных женщин вирус уходит из организма самостоятельно, без какого-либо лечения, не вызывая болезней (спонтанная элиминация). И только у небольшого процента женщин с хронической (персистентной) инфекцией, обусловленной высокоонкогенными генотипами ВПЧ, через 10-20 лет может развиться рак шейки матки.
Папилломавирусная инфекция очень коварна, и связанные с нею предраковые изменения, как правило, не только не вызывают никакого беспокойства и дискомфорта, но часто и не обнаруживаются при обычном гинекологическом осмотре.
Поэтому для выявления папилломавирусной инфекции применяется ВПЧ-тест методом полимеразной цепной реакции (ПЦР). ВПЧ-тест — надежный помощник врача: обнаружение папилломавируса и определение его генотипа позволяет определить дальнейшую тактику ведения и лечения женщины.
При этом нужно учитывать, что выявление ВПЧ группы высокого канцерогенного риска у женщин не является основанием для постановки диагноза злокачественной опухоли, но служит поводом к дальнейшему обследованию, более интенсивному наблюдению и, при необходимости, лечению предраковых изменений слизистой шейки матки.
Исход ВПЧ-инфекции зависит от генотипа вируса. Все папилломавирусы подразделяются на группы по «вредности» или «онкогенности». ВПЧ-тесты методом полимеразной цепной реакции (ПЦР) позволяют выявить все распространённые и клинически значимые генотипы ВПЧ.
Все папилломавирусы подразделяются на группы по «вредности» или «онкогенности». ВПЧ-тесты методом полимеразной цепной реакции (ПЦР) позволяют выявить все распространённые и клинически значимые генотипы ВПЧ.
К группе низкого канцерогенного риска относятся 6, 11 генотипы ВПЧ: они могут быть причиной остроконечных кондилом и дисплазий легкой степени. Анализ на ВПЧ 6 и 11 генотипов применяется для дифференциальной диагностики с заболеваниями не папилломавирусной этиологии и при обследовании беременных для оценки риска развития папилломатоза гортани у новорожденных.
- Вирус папилломы человека 6/11, качественное определение ДНК, ПЦР
К раку шейки матки чаще всех приводят 16 и 18 генотипы папилломавирусов. Они, вместе с 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68 типами входят в группу высокого канцерогенного риска. При проведении анализов на вирус папилломы человека именно на эти генотипы нужно обращать особое внимание. Наиболее важен анализ ДНК ВПЧ 16 типа и 18 типа, особенно, если их концентрация («вирусная нагрузка») высока.
- Вирус папилломы человека 16/18, качественное определение ДНК, ПЦР
- Вирус папилломы человека 16/18, количественное определение ДНК, ПЦР
- Вирус папилломы человека высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68), суммарное качественное определение ДНК, ПЦР
- Вирус папилломы человека высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52,56, 58, 59), качественное определение ДНК с указанием типа вируса
- Вирус папилломы человека высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68), суммарное количественное определение ДНК
- ВПЧ-тест расширенный (с определением количества и типа вируса)
Сдать анализ на ВПЧ у женщин методом ПЦР (ВПЧ-тест) можно самостоятельно, без направления врача. Если ВПЧ-инфекция не выявлена (отрицательный результат ВПЧ-теста), то риск развития рака шейки матки низок. Но следует помнить — при продолжении активной половой жизни риск инфицирования ВПЧ сохраняется.
Если ВПЧ-инфекция не выявлена (отрицательный результат ВПЧ-теста), то риск развития рака шейки матки низок. Но следует помнить — при продолжении активной половой жизни риск инфицирования ВПЧ сохраняется.
При положительном результате ВПЧ-теста, обнаружении ВПЧ высокого канцерогенного риска, необходимо сделать расширенное исследование для уточнения генотипа вируса (анализ ВПЧ – типирование) и «вирусной нагрузки» (вирус папилломы человека — количественный анализ). Затем необходимо обратиться к врачу-гинекологу для проведения кольпоскопии — осмотра шейки матки под увеличением с помощью специального прибора — кольпоскопа.
Все дополнительные анализы на вирус папилломы человека и другие исследования должны проводиться по назначению и под контролем врача.
Если поражение слизистой шейки матки выявлено на ранней стадии, предшествующей раку, то лечение более эффективно и практически не имеет побочных эффектов. Если не обнаружено никаких патологических изменений слизистой шейки матки, то и необходимости в лечении нет: вероятнее всего, организм справится с вирусом самостоятельно.
Однако через 1 год необходимо пройти повторное ВПЧ-тестирование и, если вирус все еще присутствует, снова обследоваться у врача-гинеколога.
Анализ на вирус папилломы человека (ВПЧ) методом ПЦР и цитологические исследования.
В России в систему обязательного медицинского страхования (ОМС) включено цитологическое исследование — «мазок на онкоцитологию». Нужны ли тогда ВПЧ-тесты?
Основой современных скрининговых программ раннего выявления онкологической патологии шейки матки является цитологическое исследование по Папаниколау (ПАП-тест, окраска по Папаниколау). К сожалению, далеко не во всех российских медицинских учреждениях используется эта методика, очень часто применяются другие, менее совершенные способы приготовления (окраски) цитологического мазка.
Кроме того важно знать, что цитологический метод – это не анализ на вирус папилломы человека. Цитология «не видит» сам вирус, а выявляет клетки эпителия, уже измененные под его воздействием, то есть клиническую и субклиническую формы ВПЧ-инфекции. У цитологического теста есть и весьма существенные недостатки — низкая чувствительность, субъективность трактовки и зависимость результата от качества взятия цитологического мазка.
У цитологического теста есть и весьма существенные недостатки — низкая чувствительность, субъективность трактовки и зависимость результата от качества взятия цитологического мазка.
Именно поэтому для традиционного цитологического скрининга характерно большое количество ложноотрицательных и неопределенных результатов, требующих повторных исследований.
Для уменьшения возможности ошибок цитологические тесты были усовершенствованы – внедрён метод жидкостной цитологии. Жидкостная цитология – новая технология приготовления образцов клеток из шейки матки для цитологического исследования. Преимущества данного метода — уменьшение количества неадекватных мазков, артефактов, возможность избежать загрязнения проб воспалительным экссудатом, эритроцитами, что обеспечивает высокое качество цитологических препаратов. Сегодня именно этот метод цитологического скрининга заболеваний шейки матки рекомендован ВОЗ (Всемирной Организацией Здравоохранения) в качестве «золотого стандарта» для исследований цервикальных мазков.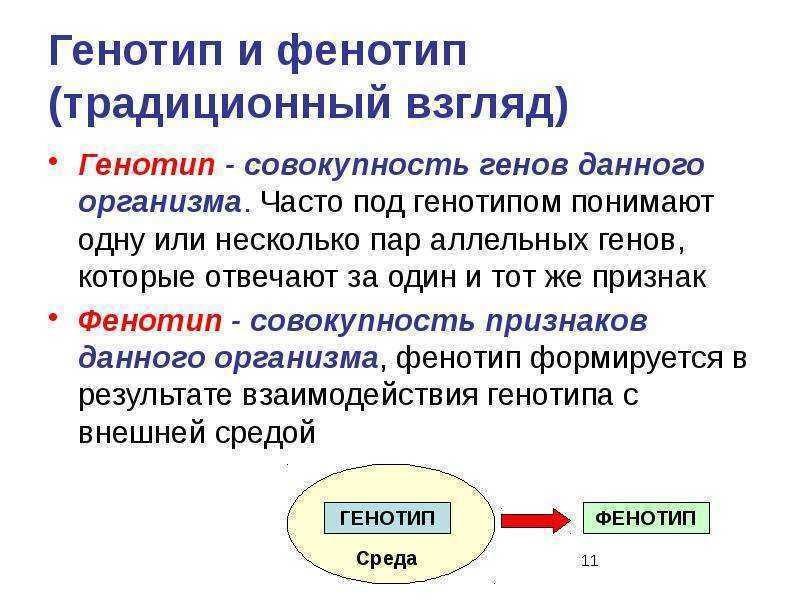
- ПАП-тест жидкостный
Согласно последним международным и отечественным рекомендациям совместное применение анализа на ВПЧ (ВПЧ-теста методом ПЦР) и цитологического исследования (ПАП-теста) является предпочтительным методом для раннего выявления онкологической патологии шейки матки у женщин старше 29 лет. Такой скрининг необходимо проходить регулярно — один раз в 3 года.
- ВПЧ-ПАП-тест (комплекс тестов: ВПЧ расширенный с определением количества и типа вируса + ПАП-тест)
- ВПЧ-ПАП-тест жидкостный (комплекс тестов: ВПЧ расширенный с определением количества и типа вируса + ПАП-тест)
| Описание количественных признаков Генетические и экологические эффекты Статистика количественных признаков Компоненты дисперсии Наследуемость Оценка фенотипа потомства Прогнозирование реакции выбора Учебные вопросы Количественные генетические накладные расходы Количественная генетика WWW-ссылки Генетические темы | Как известно, если известны аллельные взаимодействия для конкретного гена,
Генотип можно использовать для предсказания фенотипа.
Давайте рассмотрим пример с двумя генами, A и B. Мы присвоим значения метрики
каждому из аллелей.
Эти результаты могут быть представлены в графическом формате. На приведенном выше графике показано распределение данных в приведенной выше таблице. Этот график имеет колоколообразную кривую, указывающую на нормальное распределение. Это имеет важные последствия для того, каким образом количественные признаки анализируются. Этот пример демонстрирует аддитивное действие генов. Это означает, что каждый аллель имеет специфическое значение, которое вносит свой вклад в конечный фенотип. Следовательно, каждый генотип имеет немного отличающееся метрическое или количественное значение, которое приводит к распределению (или кривой) значений метрик, аналогичному подходу непрерывная кривая. Другие генетические взаимодействия, такие как доминантность или эпистаз, также влияют на
фенотип. Например, если действие доминантного гена контролирует признак, то
гомозиготный доминантный и гетерозиготный будут иметь одинаковое фенотипическое значение.
Следовательно, количество фенотипов меньше, чем при аддитивном действии генов.
Кроме того, количество фенотипов, которые являются результатом определенного генотипа
будет уменьшаться еще больше, если эпистатические взаимодействия между несколькими локусами влияют
фенотип. Все вышеперечисленные факторы имеют генетическую природу, но окружающая среда также влияет на количественные признаки. Основное воздействие окружающей среды заключается в изменить значение для конкретного генотипа. Используя наш пример выше, значение для генотипа AaBb может варьироваться от 8-10. Этот вариант будет быть результатом различных условий, в которых выращивался генотип. Следствием этого воздействия окружающей среды является то, что распределение даже больше похоже на нормальное распределение. Чтобы проиллюстрировать влияние окружающей среды на выражение генотипа,
посмотрите на урожайность озимой пшеницы в одном месте в Северной Дакоте (Касселтон,
ND) в течение последних десяти лет. (Данные были любезно предоставлены доктором Джимом Андерсоном,
Департамент наук о растениях, Государственный университет Северной Дакоты, Фарго, Северная Дакота.
Примечание : Все растения в 1990 г. пострадали от зимней гибели. Следовательно, фенотип представляет собой сумму экологических и генетических эффектов. Сформулировано в математическом формате: Фенотип = Генетические факторы + Факторы окружающей среды И одной из целей количественной генетики является измерение вклада генетических и средовых факторов на конкретный фенотип. Как вы могли бы представьте себе, область количественной генетики изучает и другие аспекты количественные признаки. вопросов, изученных специалистами по количественной генетике
 Phillip McClean Phillip McClean | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Личные генотипы — это обучающие моменты | Геномная медицина
- Обзор исследования
- Опубликовано:
- Марк С. Богуски 1 ,
- Роберт М. Богуски 2 и
- Мишель Р. Берман 3
Геномная медицина том 5 , номер статьи: 22 (2013) Процитировать эту статью
3397 доступов
11 цитирований
3 Альтметрический
Сведения о показателях
Abstract
Существует острая необходимость в эффективном обучении специалистов в области геномики. Недавний анализ учебной программы по экспериментальной геномике показал, что изучение студентами-медиками собственных генотипов дает ценный опыт обучения. Такое эмпирическое обучение имеет давнюю традицию в медицинском образовании, и его применение в геномике стало возможным благодаря все более мощной и все менее дорогостоящей науке и технологии генома. Персональное генотипирование является важным вариантом, который следует учитывать при разработке образовательных программ для медицинских работников.
Недавний анализ учебной программы по экспериментальной геномике показал, что изучение студентами-медиками собственных генотипов дает ценный опыт обучения. Такое эмпирическое обучение имеет давнюю традицию в медицинском образовании, и его применение в геномике стало возможным благодаря все более мощной и все менее дорогостоящей науке и технологии генома. Персональное генотипирование является важным вариантом, который следует учитывать при разработке образовательных программ для медицинских работников.
Расширенные возможности пациентов опережают неподготовленных специалистов
Быстрые изменения в технологиях и культурном поведении бросают вызов традиционной роли медицинских работников как «образованных посредников», которые несут ответственность за интерпретацию и перевод медицинской информации для пациентов и широкой общественности [1]. Достижения в области геномной науки и технологий быстро опережают распространение этой информации по традиционным каналам медицинского образования и обучения [2], явление, которое становится все более очевидным даже для потребителей [3]. Кроме того, исследования неоднократно показывали, что онлайн-источники и социальные сети стали основными или даже единственными источниками медицинской информации для пациентов, их друзей и семей; с медицинскими работниками консультируются позже, если вообще консультируются [1].
Кроме того, исследования неоднократно показывали, что онлайн-источники и социальные сети стали основными или даже единственными источниками медицинской информации для пациентов, их друзей и семей; с медицинскими работниками консультируются позже, если вообще консультируются [1].
Услуги генотипирования непосредственно у потребителя (DTC) способствовали отказу врачей и других медицинских работников от посредников [1]. Более того, появление «уполномоченных пациентов», практикующих «партиципаторную медицину» [4], подорвало профессиональную гегемонию и создало серьезные проблемы, но также и новые возможности для врачей. Кроме того, влияние ролевых моделей в популярной культуре, использующих ДНК-технологии для решения различных проблем со здоровьем [5], внесло еще одну мощную культурную переменную в динамику отношений между пациентом и врачом.
Для решения некоторых из этих проблем в 2009 г. были запущены две инициативы, предназначенные для студентов-медиков и аспирантов [2] и стажеров-медиков последипломного образования [6]. Обе эти программы предлагали добровольное участие в личном генотипировании в качестве педагогического усовершенствования учебных программ. В статье Vernez et al. [2] в этом выпуске Genome Medicine сообщает об опыте студентов на преддокторском факультативном курсе GENE 210 «Геномика и персонализированная медицина», проводимом в Медицинской школе Стэнфордского университета. Здесь мы рассмотрим содержание курса, его основу в теории обучения, наблюдениях и опыте студентов, а также некоторые неожиданные выводы о консультативной поддержке в программах этого типа.
Обе эти программы предлагали добровольное участие в личном генотипировании в качестве педагогического усовершенствования учебных программ. В статье Vernez et al. [2] в этом выпуске Genome Medicine сообщает об опыте студентов на преддокторском факультативном курсе GENE 210 «Геномика и персонализированная медицина», проводимом в Медицинской школе Стэнфордского университета. Здесь мы рассмотрим содержание курса, его основу в теории обучения, наблюдениях и опыте студентов, а также некоторые неожиданные выводы о консультативной поддержке в программах этого типа.
Геномика — это не генетика, а ДНК — это не судьба.
Традиционная медицинская генетика имеет специфическую направленность и целевую группу, в первую очередь изучая наследственность, и чаще всего применяется к проблемам репродуктивного здоровья и расстройствам детского возраста. Геномика больше ориентирована на снижение риска или лечение сложных многофакторных заболеваний, оценку прогноза или индивидуализацию терапии, особенно у взрослых.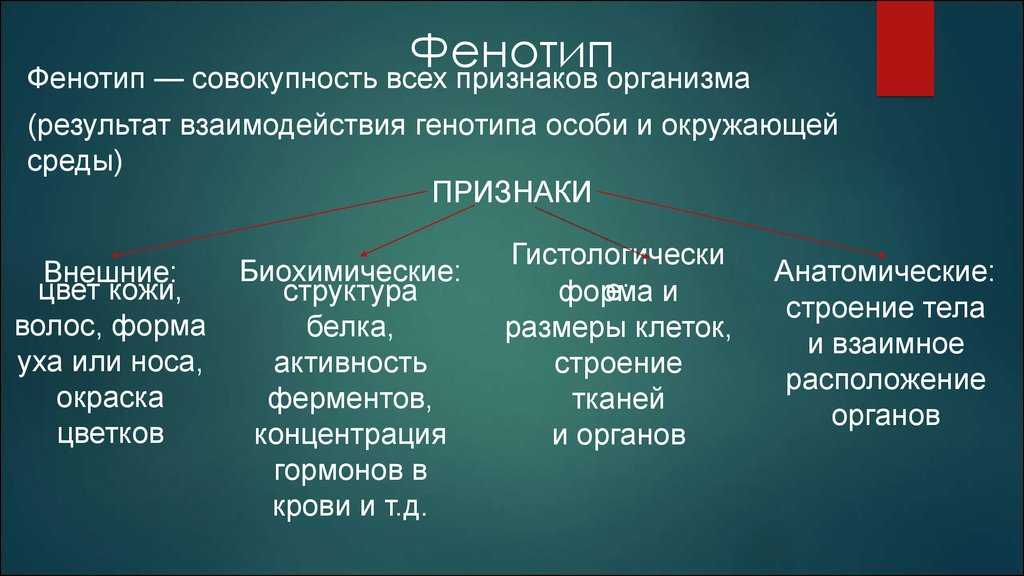
Существуют две различные категории медицинской геномики [7], факт, который не всегда очевиден и часто приводит к путанице и смешению медицинских применений и их этических, правовых и социальных последствий (ЭЛСИ). Первая категория включает пресимптоматическое генотипирование для оценки риска заболевания с использованием результатов полногеномных ассоциативных исследований (GWAS). В GWAS вариации (полиморфизмы) в нуклеотидных последовательностях геномной ДНК людей изучаются на предмет их статистической связи с различными заболеваниями или признаками болезней. Генотип человека в отношении этих однонуклеотидных полиморфизмов (SNP) может указывать на повышенную вероятность поражения или развития определенного заболевания или состояния здоровья. Эти вероятностные ассоциации, как правило, довольно слабы, и вклад этих генетических вариаций в заболевание часто сильно затмевается факторами окружающей среды (образа жизни), которые в большей степени способствуют увеличению риска таких заболеваний, как рак легких или диабет II типа. Этот тип данных генотипирования SNP был предоставлен студентам до докторантуры в Стэнфорде [2] и постдокторантам-патологам [6] в Медицинском центре Бет Исраэль Диаконисс, учебном госпитале Гарвардской медицинской школы.
Этот тип данных генотипирования SNP был предоставлен студентам до докторантуры в Стэнфорде [2] и постдокторантам-патологам [6] в Медицинском центре Бет Исраэль Диаконисс, учебном госпитале Гарвардской медицинской школы.
Вторая категория данных медицинской геномики является результатом постдиагностического генотипирования в целях прогнозирования и/или индивидуализированной терапии [8]. Например, информация о генотипах соответствующих ферментов, метаболизирующих лекарства, может использоваться для планирования индивидуальных режимов дозирования антикоагулянтов, тогда как геномное «подтипирование» рака может использоваться для оценки прогноза или выбора противоракового препарата, нацеленного на генотип. .
Экспериментальное обучение, клиническая полезность и консультативная поддержка
Экспериментальное обучение («увидеть, сделать, научить») имеет давнюю и очень полезную традицию в медицинском образовании. Например, когда студенты-медики учатся проводить медицинский осмотр, они часто практикуют такие навыки, как аускультация, на сокурсниках. Точно так же тестирование для определения собственной группы крови учащегося является еще одним широко используемым педагогическим методом доклинического медицинского образования.
Точно так же тестирование для определения собственной группы крови учащегося является еще одним широко используемым педагогическим методом доклинического медицинского образования.
Концептуально определение группы крови отличается от генотипирования технологией и областью применения. Определение группы крови — это фенотипический тест (основанный на взаимодействии антитело-антиген), который позволяет делать выводы о генотипах (последовательностях ДНК, которые кодируют белки группы крови системы ABO). Напротив, генотипирование SNP измеряет последовательности ДНК напрямую и в гораздо большем масштабе (миллионы вариаций ДНК, связанных с генами). Генотипы позволяют прогнозировать фенотипы, такие как способность метаболизировать определенные лекарства и восприимчивость к определенным заболеваниям.
По мнению экспертов в области разработки медицинских учебных программ [9], «размышление над… новым опытом, включенным в учебную программу, является ключевым компонентом экспериментального обучения». В этой формулировке личное генотипирование студентов Стэнфорда было новым опытом, и тот факт, что они использовали свои собственные данные ДНК и генотипа, вызвал более глубокие и устойчивые размышления и повышенную мотивацию к изучению материала курса. Таким образом, личное генотипирование студентов представляет собой сконструированный обучаемый момент [10] (рис. 1), основанный на непосредственном личном жизненном опыте, который, по мнению студентов, поможет им лучше относиться к будущим пациентам, которые могут пройти аналогичный тест [2].
В этой формулировке личное генотипирование студентов Стэнфорда было новым опытом, и тот факт, что они использовали свои собственные данные ДНК и генотипа, вызвал более глубокие и устойчивые размышления и повышенную мотивацию к изучению материала курса. Таким образом, личное генотипирование студентов представляет собой сконструированный обучаемый момент [10] (рис. 1), основанный на непосредственном личном жизненном опыте, который, по мнению студентов, поможет им лучше относиться к будущим пациентам, которые могут пройти аналогичный тест [2].
Обучаемые моменты отличаются сигнальным событием (также называемым триггерным или дозорным событием), которое усиливает восприятие риска, вызывает эмоциональную реакцию и/или представляет собой жизненный опыт, который меняет представление человека о себе или одна из их социальных ролей [10]. В случае с учебным планом Stanford GENE 210 сигнальным событием был опыт личного генотипирования. Опрошенные студенты в подавляющем большинстве считают, что наличие личных данных мотивирует их на получение новых знаний (учебный материал) и навыков (в биоинформатике) [2]. Студенты также выразили намерение внести скромные изменения в поведение [2]. Рисунок адаптирован с разрешения [5].
Опрошенные студенты в подавляющем большинстве считают, что наличие личных данных мотивирует их на получение новых знаний (учебный материал) и навыков (в биоинформатике) [2]. Студенты также выразили намерение внести скромные изменения в поведение [2]. Рисунок адаптирован с разрешения [5].
Изображение в натуральную величину
Студенты из Стэнфорда скептически и даже пренебрежительно отнеслись к результатам генотипирования, связанным с их предсказанием риска сложных заболеваний и когнитивно-поведенческих способностей [2]. На наш взгляд, эта реакция была уместной, учитывая состояние науки и в целом слабый, вероятностный характер большинства ассоциаций GWAS. Результаты, касающиеся метаболизма лекарств и репродуктивных проблем (т. е. тестирования на носительство), считались более актуальными и ценными, хотя и не обязательно важными для здоровых молодых людей в этой когорте. Поскольку курс в Стэнфорде был сосредоточен на досимптомном генотипировании для оценки риска заболевания, он не позволял полностью охватить более «действующее с медицинской точки зрения» генотипирование для острых постдиагностических применений, таких как прогнозирование рака и субтипирование опухолей для таргетной терапии.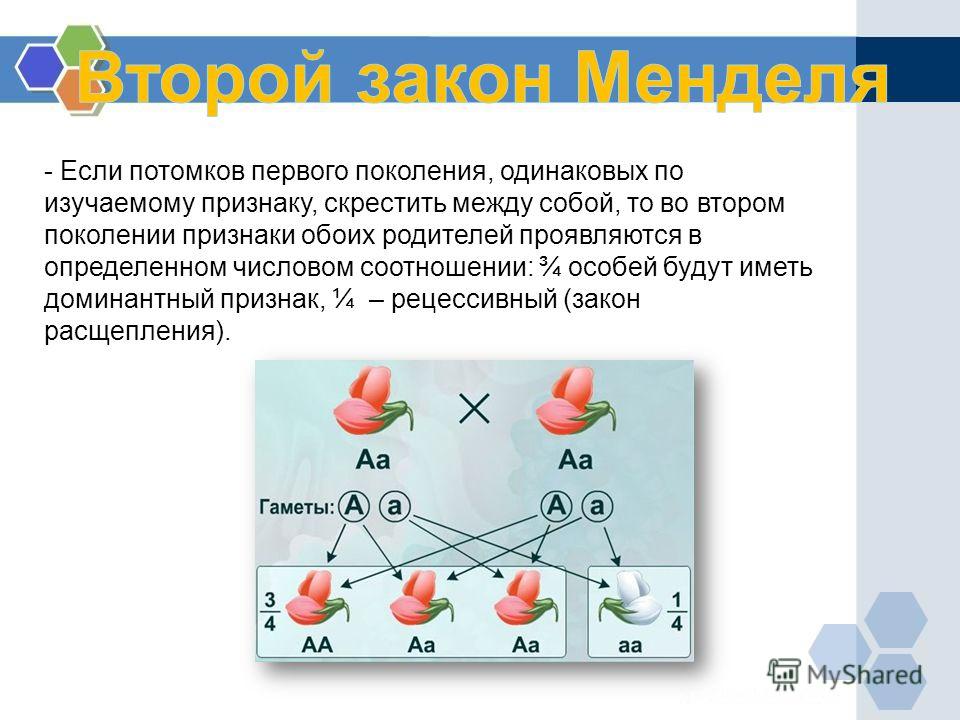
Хотя службы генетического консультирования были задуманы как важный вспомогательный компонент Стэнфордского курса, лишь немногие студенты воспользовались консультациями, и ни один из них не считал, что такое консультирование должно требоваться от студентов, зачисленных в класс [2]. Студенты полагали, что, поскольку они были обучающимися медицинскими работниками, они обладали опытом и навыками для правильной интерпретации результатов. Многие были мотивированы и заинтересованы в использовании инструментов биоинформатики для переинтерпретации своих необработанных данных, хотя некоторые чувствовали потребность в более индивидуальной помощи и консультативной поддержке для этой аналитической «добычи данных» [2].
Одной из областей образования, в которой, как ни странно, не хватало опыта, предоставляемого студентам, было понимание консультативной роли специалистов клинических лабораторий и регулируемых условий, в которых они работают. Разработчики курса, кажется, приняли как должное целостность отслеживания образцов, аналитическую достоверность анализов генотипирования и точность результатов, несмотря на широко разрекламированные ошибки, допущенные некоторыми коммерческими лабораториями. Патологи являются врачами-хранителями лабораторных исследований и важными консультантами по диагностическим тестам, определяющим значимые медицинские вмешательства [7]. Мы предлагаем, чтобы в будущих программах эти специалисты по проведению и интерпретации клинических лабораторных тестов были включены в состав междисциплинарных команд по разработке и реализации учебных программ.
Патологи являются врачами-хранителями лабораторных исследований и важными консультантами по диагностическим тестам, определяющим значимые медицинские вмешательства [7]. Мы предлагаем, чтобы в будущих программах эти специалисты по проведению и интерпретации клинических лабораторных тестов были включены в состав междисциплинарных команд по разработке и реализации учебных программ.
Выводы
Работа Vernez et al. [2] предоставляет доказательства преимуществ личного генотипирования как педагогического инструмента для обучения медицинской геномике. Этот эмпирический подход к обучению основан на хорошо зарекомендовавшей себя теории и практике обучения и, несмотря на потенциальные проблемы ELSI [2], может осуществляться таким образом, чтобы свести к минимуму риск. В будущем потребуется дополнительная работа для разработки более широкого и детального содержания курса и улучшения консультативной поддержки.
Сокращения
- Код неисправности:
напрямую потребителю
- ЭЛСИ:
этические, правовые и социальные последствия
- ГВАС:
полногеномных ассоциативных исследований
- СНП:
однонуклеотидный полиморфизм.

Ссылки
Богуски М.С.: Интернет-поиск медицинской информации потребителями и проблема личной геномики. Основы геномной и персонализированной медицины. Под редакцией: Гинзбург Г.С., Уиллард Х.Ф. 2010, 151-160. Лондон: Academic Press,
Глава Google ученый
Вернез С., Салари К., Ли С.С.: Личное тестирование генома в медицинском образовании: опыт учащихся в генотипировании в классе. Геном Мед. 2013, 5: 24-
Артикул пабмед ПабМед Центральный Google ученый
Weinstock CP: Когда генетическое тестирование может быть опасным для вашего здоровья. Журнал Опры. 2013, 95–97. http://www.oprah.com/health/Genetic-Testing-Dangers-DNA-Research-Breakthroughs#ixzz2Mr4avd6V
Google ученый
«>CelebrityDiagnosis Magazine.http://www.CelebrityDiagnosis.com
к действию: обучение резидентов патологии геномике и персонализированной медицине. Ам Джей Клин Патол. 2010, 133: 832-834.
Артикул пабмед Google ученый
Saffitz JE: Геномная патология: прорывная инновация. По мед. 2012, 9: 237-239. 10.2217/пме.12.5.
Артикул Google ученый
Богуски М.С.: Патологи и третья волна медицинской геномики. По мед. 2012, 9: 241-242. 10.2217/пме.12.27.
Артикул Google ученый
Керн Д.Э., Томас П.А., Хьюз М.Т.: Разработка учебной программы для медицинского образования: подход из шести шагов.
 2009 г., Балтимор: Издательство Университета Джона Хопкинса, 2,
2009 г., Балтимор: Издательство Университета Джона Хопкинса, 2,Google ученый
Лоусон П.Дж., Флок С.А. Моменты обучения для изменения поведения в отношении здоровья: анализ концепции. Пациент Educ Couns. 2009, 76: 25-30.
Артикул пабмед ПабМед Центральный Google ученый
Груман Дж., Смит К.В.: Почему Журнал совместной медицины?. J Particip Med. 2009 г., 1: е2-
Google ученый
Ссылки на скачивание
Благодарности
Авторы благодарят Элисон М. Богуски за стимулирующие обсуждения и критическое прочтение рукописи.
Информация об авторе
Авторы и организации
Отделение патологии, Медицинский центр Бет Исраэль Диаконисс и Центр биомедицинской информатики, Гарвардская медицинская школа, Шаттак-стрит, Бостон, Массачусетс, 02115, США
Марк С. Богуски 94041
Кафедра вычислительной медицины и биоинформатики, Медицинская школа Мичиганского университета, Washtenaw Avenue, Ann Arbor, MI, 48109-2218, USA
Robert M Boguski
Celebrity Diagnosis LLC, Newbrook Circle, Chestnut Hill, MA, 02467, USA
Michele R Berman
Авторы
- Mark S Boguski
PubMed Google Scholar
- Robert M Boguski
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Michele R Berman
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Автор, ответственный за корреспонденцию
Марк С Богуски.
 С одним геном, контролирующим
у нас есть три возможных генотипа, AA , Aa и аа и в зависимости от аллельных взаимодействий (доминирование или неполное
доминирование) мы можем иметь два или три фенотипа. Поскольку все больше и больше генов контролируют
признак, возможно большее число генотипов. Формула
который предсказывает количество генотипов от количества генов от 3 до
мощность n . (n — количество генов.) Следующее — число
генотипов для выбранного числа (n) генов, которые контролируют произвольный
черта.
С одним геном, контролирующим
у нас есть три возможных генотипа, AA , Aa и аа и в зависимости от аллельных взаимодействий (доминирование или неполное
доминирование) мы можем иметь два или три фенотипа. Поскольку все больше и больше генов контролируют
признак, возможно большее число генотипов. Формула
который предсказывает количество генотипов от количества генов от 3 до
мощность n . (n — количество генов.) Следующее — число
генотипов для выбранного числа (n) генов, которые контролируют произвольный
черта. Аллель А даст 4 единицы, в то время как аллель а
предоставит 2 ед. В другом локусе аллель В будет способствовать 2
единицы, в то время как аллель b обеспечит 1 единицу. С двумя генами, контролирующими
признак, возможны девять различных генотипов. Ниже приведены генотипы
и связанные с ними значения метрик:
Аллель А даст 4 единицы, в то время как аллель а
предоставит 2 ед. В другом локусе аллель В будет способствовать 2
единицы, в то время как аллель b обеспечит 1 единицу. С двумя генами, контролирующими
признак, возможны девять различных генотипов. Ниже приведены генотипы
и связанные с ними значения метрик:
 Аддитивные, доминантные и эпистатические эффекты могут
вносят вклад в фенотип количественного признака, но в целом аддитивны
взаимодействие важнее всего .
Аддитивные, доминантные и эпистатические эффекты могут
вносят вклад в фенотип количественного признака, но в целом аддитивны
взаимодействие важнее всего . ) Любой год
Годовая изменчивость урожайности для любого одного генотипа в значительной степени зависит от
окружение.
) Любой год
Годовая изменчивость урожайности для любого одного генотипа в значительной степени зависит от
окружение. 1
1
 2009 г., Балтимор: Издательство Университета Джона Хопкинса, 2,
2009 г., Балтимор: Издательство Университета Джона Хопкинса, 2,