Что такое геномные оценки: история и развитие
В предыдущей статье я рассказывал про селекционные индексы: что это такое, как они развивались и какие бывают в разных странах. Теперь давайте углубимся в вопрос и поговорим о ключевой составляющей селекционных индексов — о геномных оценках, об их сущности, истории и характерных особенностях.
Что такое племенная ценность
Для начала нужно разобраться с тем, что, собственно говоря, измеряют с помощью геномных оценок, а именно с племенной ценностью.
Главная задача целенаправленного селекционного разведения — отбирать лучших животных в качестве родителей для следующего поколения. Причём в разных странах, разных стадах и даже на разных временных промежутках модельными (образцовыми) животными будут считаться совершенно разные животные. Так вот, племенная ценность — это ценность животного для целей разведения по какому-либо селекционному признаку.
При этом племенная ценность бывает двух типов. Истинная племенная ценность (True Breeding Value, TBV) — это генетический потенциал животного, его реальная ценность. Измерить этот показатель мы не можем, но с определённой степенью достоверности (или точности, этим термином мы и будем пользоваться дальше) можем рассчитать оценку племенной ценности (Estimated Breeding Value, EBV).
Истинная племенная ценность (True Breeding Value, TBV) — это генетический потенциал животного, его реальная ценность. Измерить этот показатель мы не можем, но с определённой степенью достоверности (или точности, этим термином мы и будем пользоваться дальше) можем рассчитать оценку племенной ценности (Estimated Breeding Value, EBV).
EBV — это оценка генетического потенциала животного с определённой точностью. Формула расчёта оценки племенной ценности выводится следующим образом:
P = G + E,
где P — это фенотипическое проявление признака, G — генотип, E — воздействие окружающей среды. G — это и есть племенная (генетическая) ценность животного. Отсюда следует, что упрощённо племенная ценность G = P − E.
Точность оценки зависит от того, какой признак мы исследуем, каков размер референтной базы для наших исследований, насколько качественные нам доступны данные, на основе которых мы рассчитываем оценку.
EBV показывает, насколько животное по конкретному признаку отличается от среднего (базисного) животного популяции. Для расчёта базиса берут всех животных одного года рождения, высчитывают среднее значение каждого оцениваемого признака, и это значение используется для ориентира.
Для расчёта базиса берут всех животных одного года рождения, высчитывают среднее значение каждого оцениваемого признака, и это значение используется для ориентира.
Например, в США на данный момент это животные 2015 года рождения, а базис они меняют раз в 5 лет. Следующий пересчëт базиса произойдёт в 2025 году, он будет проводиться по животным 2020 года рождения. А в Новой Зеландии базис берут для животных смежных годов (2013, 2014, 2015) и пересчитывают его раз в год. Такую же рекомендацию для учëта базиса дают и в Канаде.
Как развивались племенные оценки
Чтобы улучшить своё стадо, мы можем воспользоваться одним из трёх методов отбора, которые существуют в мировой селекции. Они различаются по способу расчёта племенных оценок и в целом отражают эволюцию методов селекции. Это массовый отбор, отбор по модели животного и самый современный на данный момент метод — геномная селекция.
I. Массовый отбор (Mass Selection)
Самый простой метод, который можно использовать для оценки животных, — это массовый отбор по собственному фенотипу животного.
Плюсы. Массовый отбор можно провести у себя на ферме самостоятельно, без помощи компьютерных программ и биоинформатиков. Кроме того, это относительно быстрый и дешёвый способ отбора, потому что он не требует большого количества времени на расчёты. Но этим и исчерпываются все его преимущества.
Минусы. А вот недостатков у массового отбора много, и они существенные.
1. Животные отбираются по фенотипу, поэтому не учитывается генетическая наследуемость признака. А если наследуемость признака низкая, то мы не можем быть уверены, что разница между двумя животными обусловлена именно генетикой, а не влиянием окружающей среды (Е в формуле выше), которое включает в себя очень много факторов. В результате признаки отобранных животных не будут передаваться потомкам или будут передаваться очень плохо.
По сути, наследуемость показывает, какой вклад в фенотип признака вносит генетическая компонента. Наследуемость в теории селекционно-племенной работы оценивается с помощью показателя «коэффициент наследуемости», который представляет собой отношение генетической изменчивости к общей (фенотипической).
Допустим, у нас есть стадо со средней продуктивностью 9 000 кг за 305 дней, наследуемость удоя в этом стаде составляет 20 %, и мы хотим оценить животное с продуктивностью 12 000 кг за 305 дней. Чтобы получить оценку для этого животного, достаточно произвести такие расчёты: 12 000 − 9 000 = 3 000 × 20 % = +600 кг.
При этом нужно помнить, что при таком методе расчёта мы никак не учитываем ни факторы среды, ни саму генетическую ценность конкретного животного. Получить оценку +600 кг мы можем как при вкладе внешней среды +1 000 и вкладе генетики −400, так и при вкладе генетики +1 000 и вкладе внешней среды −400. Оба животных принесут нам одинаковый фактический результат, но, конечно, мы хотели бы оставить себе второе животное, а первое выбраковать.
То есть главная проблема метода — невозможность получить ответ на вопрос: действительно ли отобранные по фенотипу животные обладают наилучшим генетическим потенциалом? Случается также, что сравнивают лактации разных лет, и по факту отбираются не генетически лучшие животные, а просто животные, например, которым повезло родиться в удачный год.
Как итог — низкая точность оценки потенциала животного. Успешность массового отбора целиком и полностью зависит от степени наследуемости признака и внешних факторов, которые мы не можем учесть даже приблизительно. Соответственно, этот метод совершенно не работает на признаках, которые имеют низкую наследуемость. К сожалению, к таковым относятся почти все продуктивные признаки.
2. Чтобы мы могли отранжировать животных по фенотипу, у них должен быть собственный фенотип. Если животное ещё не имеет собственного фенотипа, оно не сможет участвовать в таком виде отбора, так как мы не знаем, сколько молока оно даёт. Получается, что метод массовой селекции нельзя применить к молодым животным, у которых ещё не было лактаций (к нетелям и первотёлкам), а также к быкам, потому что у них нет собственной продуктивности по большей части селекционных признаков.
Получается, что метод массовой селекции нельзя применить к молодым животным, у которых ещё не было лактаций (к нетелям и первотёлкам), а также к быкам, потому что у них нет собственной продуктивности по большей части селекционных признаков.
3. Дополнение к методу массового отбора по фенотипу — отбор по продуктивности матери. Если у животного нет собственной продуктивности (например, когда нужно принимать решение об осеменении первотёлки или когда первая лактация ещё не закончилась), его либо вообще не выбраковывают и оставляют до второй лактации, либо смотрят на удой матери (или оценку, пример которой мы разобрали выше) и по нему определяют, что делать с животным: продавать или оставить. Так же поступают и с молодыми животными — тёлками и нетелями.
Чтобы оценить таким образом ценность животного, нам нужно будет взять сумму ценностей отца и матери и разделить пополам. Если воспользоваться примером выше, то оценку +600 кг мы должны будем разделить на 2 — это и будет вклад матери в ценность этого потомка. Здесь, помимо погрешностей самого метода, мы добавляем ещё одну погрешность: мы знаем, что потомок возьмёт половину генов от матери, но никогда не знаем, какую именно.
Здесь, помимо погрешностей самого метода, мы добавляем ещё одну погрешность: мы знаем, что потомок возьмёт половину генов от матери, но никогда не знаем, какую именно.
Если же пойти совсем простым путём и не давать оценок, а просто ранжировать животных по продуктивности матерей, то надёжность такого метода в российских условиях составляет порядка 15 %. О том, что это значит, расскажем ниже.
Наиболее распространённая корреляция между удоем матери и дочери по российской базе KSITEST составляет 15 %. Обратите внимание, что от животного с удоем 10 000 мы можем получить дочь как с удоем 4 000, так и с удоем 18 000. И разницу между этими животными при методе массового отбора мы узнаем только после окончания лактации.
II. Модель животного (Animal Model)
Эта статистическая модель появилась, когда на помощь оценке животных пришли математические методы (в первую очередь метод Best Linear Unbiased Prediction, BLUP). В этой модели для получения более точной оценки племенной ценности используется информация о фенотипах родственных животных. Подробнее об истории становления BLUP я рассказывал в предыдущей статье.
В этой модели для получения более точной оценки племенной ценности используется информация о фенотипах родственных животных. Подробнее об истории становления BLUP я рассказывал в предыдущей статье.
Здесь животные оцениваются по математической модели на основе их родословных (а если у них уже есть собственный фенотип, то он может быть откорректирован — уточнён). У животного, которое мы оцениваем, есть большое количество родственников. Это как прямые родственники — отец, мать и другие предки, так и косвенные — братья и сёстры (siblings). Отсюда происходит разговорное «сибсы» — родные братья и сёстры, то есть животные с одинаковыми родителями, и «полусибсы», когда общий только один из родителей. Мы учитываем данные всех этих животных и с помощью статистических методов рассчитываем примерную продуктивность и собственно племенную оценку.
Плюсы. Этот метод позволяет оценивать животных, у которых нет собственного фенотипа, — нетелей, первотëлок, быков. Причём оценка тем точнее, чем ближе к оцениваемому животному родство животных, о которых собрана информация.
Может показаться, что это не важно, но на самом деле не бывает двух одинаковых годов и двух одинаковых ферм. Так что даже если у вас на ферме такие же технологии, как в США, в вашем случае всё равно некорректно использовать американские оценки, поскольку они не учитывают эффекты окружающей среды: корм, погоду, стадо, сезон отёла, технологию получения молока, условия содержания животного. А если бы животные действительно находились в США, тогда CDCB — организация, которая рассчитывает оценки для США, — при расчёте оценки учитывала бы в качестве фиксированного эффекта как минимум год, сезон и стадо. (Фиксированным называется эффект окружающей среды, который однозначно фиксируется, то есть записывается, при зоотехническом учёте.) Но поскольку животные находятся в России, а не в США, то никаких корректирующих коэффициентов CDCB не сможет применить, даже если захочет.
Даже если у животного есть фенотип — оценку BLUP всё равно применяют, так как она позволяет повысить точность оценки. Потому что, если мы знаем продуктивность всех родственников животного и его собственную продуктивность, мы можем более точно спрогнозировать потенциал животного, чем если мы знаем только его собственную продуктивность. Точность метода средняя — от 30 % до 50 % в зависимости от стада, качества записей в родословных и всех продуктивностей в этих записях.
Минусы. Главная опасность методов BLUP и Animal Model заключается в том, что если неправильно определено родство, неизвестен или неверно указан хотя бы один из прямых родителей, тогда наша оценка совершенно не отражает действительность, и мы не сможем прогнозировать потомство — потомок может получиться какой угодно, а не тот, которого мы прогнозировали.
Критически важна достоверная запись родословных связей и всех продуктивностей в родословных, у животных нужно постоянно подтверждать родство. А процент ошибок в родословных в мировой практике записи данных о животных доходит до 20 %, в среднем он составляет около 8 %. По данным российской базы KSITEST, в родословных в среднем тоже около 8 % ошибок. То есть в стаде из 1 000 голов у 80 коров неверно определены мать или отец.
|
|
Интересный факт: ошибки в определении отца встречаются на 10–15 % чаще, чем ошибки в определении матери (по данным российской базы KSITEST). |
|
|||
Как это работает в теории. BLUP — это математическая модель, которая учитывает фиксированные эффекты. Она рассчитывается по формуле:
Y = Xb + Zu + e,
где Y — это фенотипическая информация, Xb — фиксированные эффекты (ферма, год, сезон, возраст коровы и др. ), Zu — искомая величина, связь фенотипа и аддитивного генетического эффекта (связи в родословных), e — остаточная дисперсия.
), Zu — искомая величина, связь фенотипа и аддитивного генетического эффекта (связи в родословных), e — остаточная дисперсия.
Допустим, у нас есть определённый фактический удой, и с помощью метода BLUP мы рассчитываем все фиксированные эффекты, которые действуют на конкретное животное (их набор будет различаться для каждого региона):
Упрощённый вариант расчёта BLUP-оценки удоя по первой лактации.
Как это работает на практике. Мы берём две группы близкородственных животных, которых объединяет общий отец. Одна группа животных родилась в марте 2018 года, а вторая группа животных родилась на той же ферме от того же быка в августе 2018 года. Получается, у нас есть две группы животных, которые должны быть очень похожи, потому что у них схожие родословные, и живут они на одной ферме. Но их разделяет то, что они родились в разные сезоны.
Математическая модель рассчитывает средние показатели этих животных, и выясняется, что продуктивность у животных первой группы составляет 8 000 кг, а у животных второй группы — 9 000 кг. Это означает, что все прочие факторы у них были равные (происхождение, ферма, лактация — они родились в один год, и мы оцениваем всех по первой лактации), различается только сезон, когда они родились.
Это означает, что все прочие факторы у них были равные (происхождение, ферма, лактация — они родились в один год, и мы оцениваем всех по первой лактации), различается только сезон, когда они родились.
Мы видим, что разница между этими группами животных составляет 1 000 кг, то есть вклад сезона в данном случае составляет 1 000 кг. Это не значит, что первые животные генетически хуже, просто они родились в сезон, когда фиксированный эффект повлиял на них таким образом. При этом мы должны ещё учесть или как минимум оценить разницу в качестве матерей, так как наш упрощённый расчёт будет актуален только при всех прочих равных. Точно так же оцениваются все фиксированные эффекты, которые действуют на животных, — несколько десятков или даже сотен пунктов.
Суть в том, что для каждой генетической группы животных на уровне страны или даже региона эти фиксированные эффекты будут различаться, то есть вклад и набор фиксированных эффектов будет другой. Например, часть эффектов, которые актуальны для Израиля, будет неактуальна для Канады. Это одна из основных причин, почему все страны собирают свои собственные референтные базы — чтобы рассчитывать фиксированные эффекты. По этой же причине оценки из других стран не столь эффективны, как оценки внутри страны или региона. Так что даже если фермер работает по датской технологии, он не может просто взять и использовать датские оценки, ведь, что бы он ни делал, фиксированные эффекты в его стране будут другими.
Это одна из основных причин, почему все страны собирают свои собственные референтные базы — чтобы рассчитывать фиксированные эффекты. По этой же причине оценки из других стран не столь эффективны, как оценки внутри страны или региона. Так что даже если фермер работает по датской технологии, он не может просто взять и использовать датские оценки, ведь, что бы он ни делал, фиксированные эффекты в его стране будут другими.
III. Геномная селекция (Genomic Selection)
Геномная селекция позволяет оценивать животных на основе связей большого числа геномных данных (Single Nucleotide Polymorphism, SNP, или «снипов») с фенотипом в референтной популяции. Для этого изначально собирается референтная популяция (референтная база), по которой устанавливается, что определённый генотип соответствует определённому фенотипу. На основе этих данных мы сможем определить потенциал животного, не зная ни его фенотип, ни родословную.
Это ещё одна причина, почему каждая развитая страна имеет свою собственную референтную базу. Фенотипы у всех разные, на животных влияют разные фиксированные эффекты, и экспрессия генов под влиянием всех внешних факторов тоже происходит по-разному. Фермеры Германии действуют примерно по той же технологии, что и фермеры Франции, но при этом селекционные индексы и геномные оценки признаков у них разные, в том числе потому, что в разных условиях животные проявляют себя по-своему.
Фенотипы у всех разные, на животных влияют разные фиксированные эффекты, и экспрессия генов под влиянием всех внешних факторов тоже происходит по-разному. Фермеры Германии действуют примерно по той же технологии, что и фермеры Франции, но при этом селекционные индексы и геномные оценки признаков у них разные, в том числе потому, что в разных условиях животные проявляют себя по-своему.
Итак, мы собираем референтную базу и определяем связи между генотипом и фенотипом, а в дальнейшем можем определить потенциал животного, не имея ни его родословной, ни вообще какой бы то ни было информации о нём. Просто берём его генотип, сравниваем его с референтной базой и с определённой долей вероятности говорим, какая у этого животного будет оценка племенной ценности.
Плюсы. Этот метод даëт наиболее точную оценку и при наличии референтной базы не требует наличия фенотипа. При этом критически важно, чтобы референтная база была той же генетической группы, что и оцениваемое животное. Например, животные должны принадлежать к той же породе и родственной группе внутри породы, а также находиться в одном регионе. Кроме того, животные должны содержаться в схожих условиях и обладать частично общими родословными. Метод не чувствителен к ошибкам в родословной, потому что здесь мы ориентируемся не на родословную животного, а непосредственно на его генотип.
Например, животные должны принадлежать к той же породе и родственной группе внутри породы, а также находиться в одном регионе. Кроме того, животные должны содержаться в схожих условиях и обладать частично общими родословными. Метод не чувствителен к ошибкам в родословной, потому что здесь мы ориентируемся не на родословную животного, а непосредственно на его генотип.
Впрочем, это не значит, что животных можно оценивать только по генотипу, а больше никакой другой информации не нужно. На самом деле для получения более точной оценки важно использовать максимум имеющихся данных: и собственный фенотип животного, и данные о его родственниках. Кроме того, нужно пополнять и регулярно обновлять референтную базу, которая используется для расчёта оценок. Генетические связи постоянно меняются в ходе селекционного процесса, так что через 3–4 поколения изменённые связи будут давать меньшую точность оценки. Соответственно, если оценивать коров, родившихся в 2022 году, по базе, собранной в 2008 году и с тех пор не обновлявшейся, их оценка будет совершенно неактуальна.
Точность метода — 60–90 % при условии, что мы используем всю доступную информацию: геном, родословные и фенотипы. При этом точность для коров и быков отличается во всех трёх методах. Даже с геномной селекцией точность оценки в 80 % — это очень хороший результат и, скорее всего, будет встречаться у матерей быков, так как для коров доступно ограниченное количество информации, которое мы можем использовать для оценки (у них меньше собственных потомков). Для быков же оценка с точностью выше 80 % может быть получена только после добавления генотипов и фенотипов нескольких десятков потомков, не говоря уже о том, что часто практически вся родословная условного быка-производителя будет с генотипами.
Особенности метода. Для формирования качественной референтной базы важно собрать достоверную информацию о родственных связях животных. Но это решается средствами самой геномной селекции, потому что, когда животное генотипируется, его родство можно сразу же подтвердить по генотипу, если родители животного тоже были прогенотипированы. А если родство не подтверждено или даже опровергнуто, то в референтной базе можно найти животное, которое генетически соответствует оцениваемому животному. Так можно исправлять ошибки или заполнять пробелы в родословных.
А если родство не подтверждено или даже опровергнуто, то в референтной базе можно найти животное, которое генетически соответствует оцениваемому животному. Так можно исправлять ошибки или заполнять пробелы в родословных.
Референтная база. Для метода геномной селекции важен размер референтной популяции — эталонной популяции, для которой существуют связи фенотипа и генотипа (набора генетических маркёров SNP). Нужно довольно много животных, чтобы собрать наиболее полную базу с разными вариантами аллелей каждого гена (у каждого SNP есть два аллеля, и всего может быть три варианта каждого генотипа — гомозиготный по первому аллелю, гомозиготный по второму аллелю и гетерозиготный).
Чем ниже наследуемость признака, тем больше животных нужно для референтной базы. Чтобы была возможность получить оценку в 90 % для признаков со сравнительно высокой наследуемостью (удой, жир и белок), необходимо больше 8 000 животных со связями генотипов с фенотипами. Для признаков с очень низкой наследуемостью (например, различные признаки здоровья) достичь точности в 90 % не представляется возможным, так как на проявление признака влияет слишком много внешних факторов.
Влияние размера популяции и наследуемости признаков на точность оценки: чем ниже наследуемость признака, тем большая нам нужна популяция для более точной оценки.
Как это работает. После того как были собраны связи генотипов с фенотипами, строится модель — уравнение предсказания (prediction equation), которое помогает понять, как оценивать признак. Дальше мы берём животных с уже известным фенотипом, удаляем его, сообщаем программе, что мы не знаем фенотип этих животных, и даём программе команду его оценить. Соответственно, животные оцениваются по уравнению, которое мы построили на предыдущем шаге, и получают свою оценку генетического потенциала по признакам.
Дальше мы сообщаем программе, что теперь у нас есть фенотип, и программа начинает высчитывать точность этой оценки — насколько она соответствует действительности (конечно, с учётом фиксированных эффектов). То есть насколько мы оказались правы в том, что такая-то корова с учётом фиксированных эффектов и получившегося фенотипа должна иметь оценку +1000 или −1000. Если точность оценки недостаточная — необходимо понять, какие факторы внешней среды не учтены или учтены неправильно.
Если точность оценки недостаточная — необходимо понять, какие факторы внешней среды не учтены или учтены неправильно.
Когда мы поняли, что нас устраивает определённая точность оценки, и утвердили соответствующую модель, в дальнейшем мы уже можем брать животных без фенотипов и определять их оценку с помощью геномной селекции, сравнивая генотип животного с генотипами животных в референтной базе.
Нюанс в том, что животное должно обладать большим количеством генетических связей с референтной популяцией. Если это животное той же самой породы, но генетические связи абсолютно другие, то ценность оценки будет очень низкой, потому что может не оказаться животных с таким же набором «снипов» (с такими же вариантами аллелей) — например, из-за того, что у местных животных было много примесей других пород. Таким образом, референтная база должна соответствовать локальной популяции, а ещë она должна быть живой и постоянно пополняться новыми данными — генотипами и фенотипами.
***
На этом давайте пока остановимся. В следующей статье я расскажу про нюансы использования геномных оценок, которые остались не затронутыми здесь. Но уже сейчас можно сказать, что геномная селекция — это самый современный и эффективный способ оценить племенную ценность КРС.
А 2 ноября, вместе с зарубежными коллегами, я буду разбирать ньюансы геномных оценок и как геномная селекция способствует импортозамещению в животноводстве на 2-й практической конференции KSIDAY 2022. Регистрируйтесь по ссылке ksiday.ru, чтобы прокачать свои знания в геномной селекции.
Генотип, фенотип и норма реакции в условиях температурного стресса
В настоящем сообщении предпринята попытка оценки влияния температурного стресса в период раннего онтогенеза пчел на морфогенетические процессы, лежащие в основе снижения неспецифической устойчивости.
Медоносная пчела обладает широким диапазоном и уровнем естественной устойчивости, сформировавшимся в процессе эволюции вида. Это обстоятельство наряду с другими причинами позволило ей распространиться по всем континентам, за исключением Антарктиды. Однако до настоящего времени проблема устойчивости пчел к биотическим и абиотическим факторам внешней среды остается одной из ведущих проблем отечественных пчеловодов.
Это обстоятельство наряду с другими причинами позволило ей распространиться по всем континентам, за исключением Антарктиды. Однако до настоящего времени проблема устойчивости пчел к биотическим и абиотическим факторам внешней среды остается одной из ведущих проблем отечественных пчеловодов.
В наш век, несмотря на совершенство методов пчеловодства и интенсивное использование ветпрепаратов для профилактики и лечения вирусных и паразитарных болезней, гибель семей до и после зимовки сохраняется на высоком уровне. Естественно, возникает вопрос: почему же искусственно созданные популяции с генетически детерминированными и эволюционно закрепленными механизмами устойчивости в условиях интенсивного пчеловодства не могут реализовать свой наследственный потенциал?
От генотипа к фенотипу. При ответе на поставленный вопрос необходимо иметь в виду, что в процессе наследования происходит передача потомству не конкретных признаков или свойств, а лишь возможность их реализации. Эта возможность в ряде случаев определяется факторами внешней среды, то есть фенотип — результат взаимодействия генотипа и условий развития, среди которых температурный режим играет значительную роль. Классический пример влия-ния температурного режима в период раннего онтогенеза на степень выраженности признака приведен в работе Т.Моргана (Морган, 1919, цит. по Шмальгаузену, 1968). Длина крыльев у плодовой мушки дрозофилы с мутацией vestigial (короткие крылья) зависит от температурных условий выращивания личинок. При высоких температурах (32°С) у мух развиваются крылья почти нормальной длины. При низких температурах (18–25°С) крылья становятся практически рудиментарными.
Эта возможность в ряде случаев определяется факторами внешней среды, то есть фенотип — результат взаимодействия генотипа и условий развития, среди которых температурный режим играет значительную роль. Классический пример влия-ния температурного режима в период раннего онтогенеза на степень выраженности признака приведен в работе Т.Моргана (Морган, 1919, цит. по Шмальгаузену, 1968). Длина крыльев у плодовой мушки дрозофилы с мутацией vestigial (короткие крылья) зависит от температурных условий выращивания личинок. При высоких температурах (32°С) у мух развиваются крылья почти нормальной длины. При низких температурах (18–25°С) крылья становятся практически рудиментарными.
Количественные изменения морфометрических признаков у пчел наблюдала М.Д.Еськова (2010). По ее данным, у пчел, развивавшихся при относительно высокой температуре, сокращались размеры тела и крыльев, а так же увеличивалась длина хоботка. Таким образом, температурный фактор способен влиять на «норму реакции», то есть степень выраженности признака, контролируемую генами.
Устойчивость — это генетически детерминированное свойство организма обеспечивать жизнеспособность при значительных неблагоприятных воздействиях. Она является результатом взаимодействия множества функционально связанных генов, объединенных в сложные иерархические системы генетических сетей, и факторов внешней среды.
Для формирования устойчивого фенотипа пчел исключительно важным является эмбриональный период развития. В это время отклонение температурного режима от оптимального приводит к нарушению целого ряда биохимических и морфогенетических процессов, и как следствие к снижению неспецифической устойчивости пчел.
Пчелиный расплод в условиях температурного стресса. Температурный стресс — это неспецифическая комплексная ответная реакция организма на экстремальные температурные условия развития, направленная на поддержание внутриклеточного гомеостаза. В отличие от взрослых особей, которые способны длительно выдерживать колебания температуры в широких диапазонах, пчелиный расплод проявляет особую чувствительность к температурным условиям существования. Оптимальная температура в расплодной части гнезда лежит в узком диапазоне — от 33 до 35°С. Оптимальной считается температура, при которой наблюдается наименьшая гибель появляющихся из расплода пчел. Оптимальный температурный диапазон оптимален как для развития рабочих пчел, так и для развития маток и трутней. По данным Е.К.Еськова (1995), при температуре 33–35°С до стадии имаго не доживает 2% расплода рабочих пчел, 4% расплода трутней и 6% расплода маток. Верхний предел температурной зависимости лежит на уровне 38–39°С, нижний – на уровне 28–29°С. За гранью указанных температур отмечается почти 100%-ная гибель расплода. Зависимость его гибели от температурных условий существования показана на графике. Таким образом, витальный температурный диапазон развития лежит в относительно узком диапазоне — 10°С.
Оптимальная температура в расплодной части гнезда лежит в узком диапазоне — от 33 до 35°С. Оптимальной считается температура, при которой наблюдается наименьшая гибель появляющихся из расплода пчел. Оптимальный температурный диапазон оптимален как для развития рабочих пчел, так и для развития маток и трутней. По данным Е.К.Еськова (1995), при температуре 33–35°С до стадии имаго не доживает 2% расплода рабочих пчел, 4% расплода трутней и 6% расплода маток. Верхний предел температурной зависимости лежит на уровне 38–39°С, нижний – на уровне 28–29°С. За гранью указанных температур отмечается почти 100%-ная гибель расплода. Зависимость его гибели от температурных условий существования показана на графике. Таким образом, витальный температурный диапазон развития лежит в относительно узком диапазоне — 10°С.
Разные стадии развития расплода неодинаково реагируют как на колебания температуры в пределах витального диапазона, так и времени этого воздействия. Повышение температуры за пределы оптимума ведет к большей гибели расплода, чем понижение температуры.
Эмбриональная стадия. Из яиц, инкубируемых при оптимальной температуре и относительной влажности в пределах 71–82%, вылупляется около 95% личинок. При инкубации при 30°С гибель эмбрионов возрастает в 5–8 раз, при инкубации при 38°С — в 6–10. Однако краткая (1,5 ч) экспозиция яиц при 0°С ведет к гибели лишь 16% эмбрионов; остальные (где-то 80%) нормально заканчивают постэмбриональное развитие выходом пчел из ячеек.
Личиночная стадия развития. На личиночной стадии развития пчелиный расплод нуждается в частых контактах с пчелами, поддерживающими оптимальный температурный режим в улье. Как было установлено, при инкубации в искусственных условиях динамика гибели личинок в течение первых трех суток несущественно отличается при колебаниях температуры в диапазоне 7,5°С. От температуры существенно зависят изменения массы личинок: при 29°С за первые сутки масса тела уменьшалась в среднем на 2%, на 2-е — на 6,8% и на 3-и сутки — на 14% от нормы. При 34°С изменения были выше в среднем в 1,8 раза, при 37°С – в 2,5 раза. Гипертермия многократно сокращает продолжительность жизни личинок и предкуколок. Через сутки жизни при 29,5°С на стимуляцию током не реагировало 4% особей, на 2-е сутки — 6% и на 3-и сутки – 10% особей; при 37°С у 14, 20 и 39% особей соответственно отсутствовала реакция на стимуляцию током. Несмотря на то что время жизни некоторой части личинок значительно превосходило продолжительность личиночной стадии, ни одна из них не превратилась в куколку.
Гипертермия многократно сокращает продолжительность жизни личинок и предкуколок. Через сутки жизни при 29,5°С на стимуляцию током не реагировало 4% особей, на 2-е сутки — 6% и на 3-и сутки – 10% особей; при 37°С у 14, 20 и 39% особей соответственно отсутствовала реакция на стимуляцию током. Несмотря на то что время жизни некоторой части личинок значительно превосходило продолжительность личиночной стадии, ни одна из них не превратилась в куколку.
Колебания температуры на более поздних стадиях развития, например на стадии запечатанного расплода, хотя и не влияют на сам процесс органогенеза, тем не менее сопровождаются гибелью большого числа уже почти сформированных особей. Инкубация запечатанного расплода при 28°С приводит к элиминации 62% развивающихся пчел. Пчелы погибают, не предпринимая попыток выйти из ячеек, хотя и достигают того этапа развития, на котором возможна локомоторная активность.
Таким образом, все стадии доимагинального развития высоко чувствительны к колебаниям температуры за пределами оптимальной.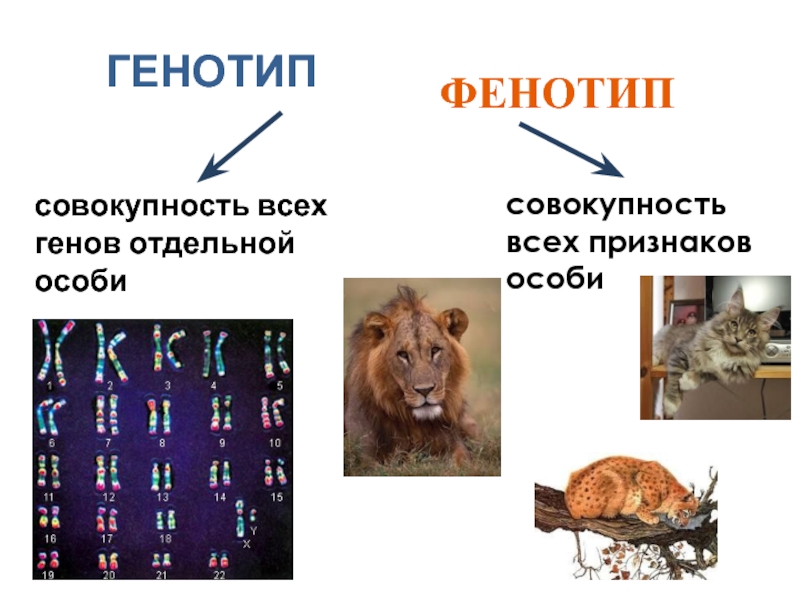 При этом, как уже отмечалось, гипертермия ведет к более серьезным последствиям, чем гипотермия.
При этом, как уже отмечалось, гипертермия ведет к более серьезным последствиям, чем гипотермия.
Температурный стресс как реакция адаптации. У всех животных переключение нормальной жизни клетки на стрессовую осуществляется на многих уровнях регуляции. Оно заключается в репрограммировании генома — тормозится экспрессия генов, активность которых характерна для жизни клетки в нормальных условиях, и активируются гены стрессовых белков (Жимулев, 2003). При воздействии высоких температур (мРНК — информационная РНК) кодирующие стрессовые белки обнаруживаются уже через 5 мин от начала стресса, а сами стрессовые белки отмечались в клетках уже через 15 мин после начала теплового шока. Их синтез активируется, достигая максимума за 2–4 ч теплового шока, а затем при снятии его начинает ослабевать, после окончания температурного воздействия синтез специфических белков прекращается, и возобновляется синтез белков, характерный для клетки при нормальных температурных условиях. При этом мРНК стрессовых белков быстро разрушаются в клетках, тогда как сами белки могут сохраняться существенно дольше, обеспечивая, по-видимому, повышение устойчивости клетки к нагреванию.
Длительное пребывание клеток в условиях теплового шока обычно также приводит к ослаблению и прекращению синтеза стрессовых белков. В этом случае включаются механизмы регуляции экспрессии генов стрессовых белков по принципу обратной связи.
Стрессовые белки представлены белками теплового шока (БТШ), низкомолекулярными белками теплового шока (нмБТШ), а также рядом ферментов (включая антиоксидантные ферменты). Главная функция БТШ состоит в правильной укладке вновь синтезированных полипептидов и в реукладке неверно уложенных и поврежденных полипептидных цепей (Жимулев, 2003).
В отличие от теплового шока холодовой шок в пределах положительных низких температур не вызывает денатурации белков, но ведет к изменению конформации молекул и изменению биохимических реакций. При холодовом стрессе происходит стабилизация вторичной структуры нуклеиновых кислот и, как следствие, ингибирование важнейших генетических процессов (ДНК-репликации, генной транскрипции и трансляции). Снижается активность многих ферментов и общего метаболизма, а также проницаемость мембран, что затрудняет транспорт веществ в клетку. Однако в клетках существует ряд механизмов, помогающих адаптироваться к гипотермии. Так, описан механизм, связанный с разобщением окисления и фосфорилирования в митохондриях. Воздействие низкотемпературного стресса также вызывает синтез специфических стрессовых белков, по аналогии с белками теплового шока, названных белками холодового шока (БХШ), которые вовлекаются в синтез белков и укладку мРНК.
Однако в клетках существует ряд механизмов, помогающих адаптироваться к гипотермии. Так, описан механизм, связанный с разобщением окисления и фосфорилирования в митохондриях. Воздействие низкотемпературного стресса также вызывает синтез специфических стрессовых белков, по аналогии с белками теплового шока, названных белками холодового шока (БХШ), которые вовлекаются в синтез белков и укладку мРНК.
Морфологическим проявлением генетической активности в ответ на повышение температуры на цитологическом уровне является формирование специфически активных районов хромосом — пуфов. Пуфы теплового шока на политенных хромосомах слюнных желез личинок дрозофилы образуются при повышении температуры с 20 до 37°С там, где они не появлялись при нормальной температуре. Такие же пуфы возникают в ответ на ферментные яды, блокирующие окислительное фосфорилирование. Реакция клеток на индуцирующие факторы очень быстрая. Формирование пуфов начинается уже через одну минуту после повышения температуры, в течение 20–30 мин они достигают максимальных размеров, а затем в течение нескольких часов регрессируют.
В последнее время обнаружена еще одна ответная реакция, возникающая под действием теплового и холодового шока, — активизация перемещений мобильных генетических элементов (МГЭ) (Пивоварова, Васильева, 2004). В экспериментах с некоторыми мутантными линиями плодовой мушки Drosophila melanogaster была показана активизация перемещений МГЭ под действием высоких и низких температур в период созревания мужских половых клеток (при спермиогенезе). Известно, что такое явление может сопровождаться генетическими эффектами, связанными с активацией и инактивацией генов, а также появлением структурных изменений хромосом. В силу этого генетические последствия теплового стресса могут проявляться в ряду следующих поколений.
Температурный стресс и жизнь пчелиной семьи. Приведенные выше данные неопровержимо свидетельствуют о том, что колебания температурного режима выше и ниже оптимальных значений вызывают серьезные изменения на молекулярном и цитологическом уровне, способных привести к гибели организма. Особенно чувствительными к колебанию температуры оказываются эмбриональные стадии, так как в это время происходят закладка всех органов и становление всех жизненно важных функций организма. Нарушение теплового режима нарушает временную согласованность работы эмбриональных генов, что и является одной из причин проявления летальности пчел, недоразвития органов и снижения показателей общей жизнеспособности отдельных особей. Все это, безусловно, сказывается на жизнеспособности пчелиной семьи в целом. Пчелы, пережившие тепловой или холодовой стресс, по всей видимости, обладают сниженными показателями жизнеспособности, сниженной способностью к полноценному выкармливанию потомства и сбору нектара. Систематические температурные стрессы, несомненно, снижают общую неспецифическую и специфическую устойчивость пчелиной семьи.
Особенно чувствительными к колебанию температуры оказываются эмбриональные стадии, так как в это время происходят закладка всех органов и становление всех жизненно важных функций организма. Нарушение теплового режима нарушает временную согласованность работы эмбриональных генов, что и является одной из причин проявления летальности пчел, недоразвития органов и снижения показателей общей жизнеспособности отдельных особей. Все это, безусловно, сказывается на жизнеспособности пчелиной семьи в целом. Пчелы, пережившие тепловой или холодовой стресс, по всей видимости, обладают сниженными показателями жизнеспособности, сниженной способностью к полноценному выкармливанию потомства и сбору нектара. Систематические температурные стрессы, несомненно, снижают общую неспецифическую и специфическую устойчивость пчелиной семьи.
Приемы рационального пчеловодства — ранняя выставка на облет, раннее применение противороевых мер: деление семьи пополам, создание отводков, расширение гнезд, а также ранняя постановка магазинных надставок, частый осмотр пчел — ведут к нарушению теплового режима улья. Он изменяется также при частом и небрежном осмотре семей, переносе рамок, при избыточном открытии верхних и нижних летков в ранний весенний период. Последствия температурного стресса наиболее опасны в тот период, когда идет наращивание силы семьи. В летнее время аналогичные последствия испытывает семья при гипертермии. Особенно чувствительными к нарушению оптимального теплового режима оказываются слабые и средние по силе семьи. Именно они в полной мере испытывают все негативные последствия температурного шока, которые существенно ослабляют их силу к моменту медосбора и создают предпосылки для развития заболеваний. Нарушения теплового режима могут быть относительно быстро компенсированы только сильными семьями.
Он изменяется также при частом и небрежном осмотре семей, переносе рамок, при избыточном открытии верхних и нижних летков в ранний весенний период. Последствия температурного стресса наиболее опасны в тот период, когда идет наращивание силы семьи. В летнее время аналогичные последствия испытывает семья при гипертермии. Особенно чувствительными к нарушению оптимального теплового режима оказываются слабые и средние по силе семьи. Именно они в полной мере испытывают все негативные последствия температурного шока, которые существенно ослабляют их силу к моменту медосбора и создают предпосылки для развития заболеваний. Нарушения теплового режима могут быть относительно быстро компенсированы только сильными семьями.
Все спасение — в сильных семьях – так считали классики пчеловодства.
М.А.МОНАХОВА
Биологический факультет
Московского государственного университета им. М.В.Ломоносова
И.И.ГОРЯЧЕВА
Учреждение Академии наук Институт общей генетики
им. Н.И.Вавилова РАН
Н.И.Вавилова РАН
Проведен анализ влияния по гипо- и гипертермии в эмбриональный и постэмбриональный период развития на жизнеспособность пчелиного расплода. Показано, что температурный стресс вызывает значительные изменения в структурно-функциональной организации генетической системы и экспрессии отдельных генов. Предполагается, что нарушение оптимальных температурных условий развития пчелиного расплода является одной из причин жизнеспособности, а также специфической и неспецифической устойчивости пчелы медоносной.
ЛИТЕРАТУРА
1. Еськов Е.К. Экология медоносной пчелы. — Рязань, 1993.
2. Еськова М.Д. Перегрев улья и развитие расплода // Пчеловодство. — 2010.
3. Жимулев И.Б. Пуфы теплового шока и синдром клеточного стресса. // Молекулярный механизм генетических процессов. — Новосибирск, 2003.
4. Пивоварова О.В., Васильева Л.А. Стрессовая индукция транспозиции ретротранспозонов mdg1 на разных стадиях сперматогенеза у самцов D. Melanogaster. // Экол. генетика. — 2004. — Т 2. — №3.
— 2004. — Т 2. — №3.
5. Шмальгаузен И.И. Факторы эволюции. Теория стабилизирующего отбора. — М.: Наука, 1968.
Поделиться с друзьями
Читайте также
мая 12, 2018фев 7, 2023янв 13, 2022нояб 10, 2014июль 11, 2018фев 13, 2015июль 17, 2014сен 1, 2018мая 3, 2015мая 26, 2017янв 3, 2023окт 30, 2016дек 17, 2015нояб 27, 2017мая 20, 2014
Ложноотрицательный фенотип — PubMed
. 2019 Январь; 143 (Приложение 1): S33-S36. doi: 10.1542/пед.2018-1099Г.Джон Д Лантос 1
принадлежность
- 1 Медицинский факультет Университета Миссури в Канзас-Сити и Центр биоэтики детского милосердия, Канзас-Сити, Миссури jlantos@cmh.
 edu.
edu.
- PMID: 30600269
- DOI: 10.1542/пед.2018-1099Г
Джон Д Лантос. Педиатрия. 2019 Январь
. 2019 Январь; 143 (Приложение 1): S33-S36. doi: 10.1542/пед.2018-1099г.Автор
Джон Д Лантос 1
принадлежность
- 1 Медицинский факультет Университета Миссури в Канзас-Сити и Центр биоэтики детского милосердия, Канзас-Сити, Миссури [email protected].
- PMID: 30600269
- DOI:
10.
 1542/пед.2018-1099Г
1542/пед.2018-1099Г
Абстрактный
Этические разногласия могут возникнуть, когда секвенирование генома выявляет генетический вариант, который считается патогенным, но у пациента нет симптомов. Это может быть связано с переменной пенетрантностью или экспрессивностью. Это также может быть результатом неправильной классификации гена как патогенного. В этой статье я анализирую 2 возможности возникновения такой ситуации. Первый прямолинеен. Мы могли бы сделать вывод, что результаты секвенирования следует считать «ложноположительным» результатом теста. Второй немного более контринтуитивен. В некоторых случаях мы могли бы считать результат теста истинно положительным, но таким образом, который еще не привел к фенотипическим выводам. Несколько игриво мы представляем, что в таких случаях мы могли бы считать фенотип пациента ложноотрицательным. Иногда, как это ни странно, мы поступаем так, как будто верим в это.
Copyright © 2019 Американской академии педиатрии.
Заявление о конфликте интересов
ПОТЕНЦИАЛЬНЫЙ КОНФЛИКТ ИНТЕРЕСОВ: Автор указал, что у него нет потенциальных конфликтов интересов, о которых следует сообщать.
Похожие статьи
- Полное секвенирование экзома в сочетании с прогнозированием встроенных аннотаций идентифицирует причинный вариант эссенциальной легкой цепи миозина при гипертрофической кардиомиопатии.
Номура А., Тада Х., Терамото Р., Конно Т., Ходацу А., Вон Х.Х., Катиресан С., Ино Х., Фуджино Н., Ямагиши М., Хаяси К. Номура А. и соавт. Дж Кардиол. 2016 фев; 67 (2): 133-9. doi: 10.1016/j.jjcc.2015.09.003. Epub 2015 9 октября. Дж Кардиол. 2016. PMID: 26443374
- ИКД для первичной профилактики у пациентов с наследственными заболеваниями сердца: показания, применение и исход: сравнение со вторичной профилактикой.

Olde Nordkamp LR, Wilde AA, Tijssen JG, Knops RE, van Dessel PF, de Groot JR. Olde Nordkamp LR и др. Цирк Аритмия Электрофизиол. 2013 Февраль;6(1):91-100. doi: 10.1161/CIRCEP.112.975268. Epub 2012 29 декабря. Цирк Аритмия Электрофизиол. 2013. PMID: 23275262
- Клинико-генетическая диагностика семейной гипертрофической кардиомиопатии: Результаты детской кардиологии.
Кардосо Б., Гомес И., Лурейро П., Триго С., Феррейра Пинту Ф. Кардосо Б. и др. Преподобный Порт Кардиол. 2017 март; 36(3):155-165. doi: 10.1016/j.repc.2016.09.009. Epub 2017 15 февраля. Преподобный Порт Кардиол. 2017. PMID: 28214152 английский, португальский.
- Использование и интерпретация генетических тестов в сердечно-сосудистой генетике.
Калешу С.
 , Дэй С., Рем Х.Л., Бакстер С.
Калешу С. и др.
Сердце. 2010 октябрь; 96(20):1669-75. doi: 10.1136/hrt.2009.1
, Дэй С., Рем Х.Л., Бакстер С.
Калешу С. и др.
Сердце. 2010 октябрь; 96(20):1669-75. doi: 10.1136/hrt.2009.1. Сердце. 2010. PMID: 20937756 Обзор. Аннотация недоступна.
- Современный подход к гипертрофической кардиомиопатии.
Ho CY, Seidman CE. Ho CY и соавт. Тираж. 2006 20 июня; 113 (24): e858-62. doi: 10.1161 / CIRCULATIONAHA.105.591982. Тираж. 2006. PMID: 16785342 Обзор. Аннотация недоступна.
Посмотреть все похожие статьи
Цитируется
- Полный спектр этических вопросов при секвенировании всего генома у детей: систематический качественный обзор.
Эйхингер Дж., Элгер Б.С., Коне И., Филгес И., Шоу Д., Циммерманн Б., Макленнан С. Эйхингер Дж.
 и соавт.
БМС Педиатр. 2021 6 сентября; 21 (1): 387. doi: 10.1186/s12887-021-02830-w.
БМС Педиатр. 2021.
PMID: 34488686
Бесплатная статья ЧВК.
и соавт.
БМС Педиатр. 2021 6 сентября; 21 (1): 387. doi: 10.1186/s12887-021-02830-w.
БМС Педиатр. 2021.
PMID: 34488686
Бесплатная статья ЧВК.
Типы публикаций
термины MeSH
Грантовая поддержка
- U19 HD077627/HD/NICHD NIH HHS/США
- U19 HD077632/HD/NICHD NIH HHS/США
- U19 HD077671/HD/NICHD NIH HHS/США
- U19 HD077693/HD/NICHD NIH HHS/США
От генотипа к фенотипу: почему фенотип человека не всегда можно предсказать по последовательности его генома и среде, в которой он находится
Обзор
. 2012 г., октябрь; 279 (20): 3765-75. doi: 10. 1111/j.1742-4658.2012.08810.x.
Epub 2012 27 сентября.
1111/j.1742-4658.2012.08810.x.
Epub 2012 27 сентября.Алехандро Бурга 1 , Бен Ленер
принадлежность
- 1 Генетические системы, Исследовательский отдел системной биологии EMBL/CRG, Центр геномной регуляции (CRG) и UPF, Барселона, Испания.
- PMID: 22934970
- DOI: 10.1111/j.1742-4658.2012.08810.x
Обзор
Алехандро Бурга и др. ФЕБС Дж. 2012 Октябрь
Бесплатная статья . 2012 г., октябрь; 279 (20): 3765-75. doi: 10.1111/j.1742-4658.2012.08810.x.
Epub 2012 27 сентября.
2012 г., октябрь; 279 (20): 3765-75. doi: 10.1111/j.1742-4658.2012.08810.x.
Epub 2012 27 сентября.Авторы
Алехандро Бурга 1 , Бен Ленер
принадлежность
- 1 Генетические системы, Исследовательский отдел системной биологии EMBL/CRG, Центр геномной регуляции (CRG) и UPF, Барселона, Испания.
- PMID: 22934970
- DOI: 10.1111/j.1742-4658.2012.08810.x
Абстрактный
Одно из обещаний персонализированной медицины заключается в том, что можно будет делать полезные прогнозы о фенотипах людей на основе полных последовательностей их геномов (например, в отношении их восприимчивости к болезням). Однако в какой степени знания о генотипе индивидуума вместе с информацией об окружающей среде, в которой он находился, достаточны для предсказания фенотипической изменчивости? В настоящем обзоре мы утверждаем, что, хотя «типичный» фенотипический результат генома человека можно предсказать, гораздо труднее предсказать фактический результат для конкретного человека. Мы выделяем три причины этого. Во-первых, на исход мутаций могут влиять случайные (стохастические) процессы. Во-вторых, генетическая изменчивость, присутствующая в одном поколении, может влиять на фенотипические признаки в следующем поколении, даже если люди не наследуют эту изменчивость. В-третьих, окружающая среда, с которой сталкивается одно поколение, может влиять на фенотипическую изменчивость в следующем поколении. Этот вклад в фенотипическую изменчивость уже давно оценили количественные генетики, хотя только недавно они были изучены на молекулярном уровне. Взятые вместе, они означают, что во многих случаях генотипы индивидуумов и среда, с которой они сталкиваются, могут быть недостаточными для определения их фенотипов.
Однако в какой степени знания о генотипе индивидуума вместе с информацией об окружающей среде, в которой он находился, достаточны для предсказания фенотипической изменчивости? В настоящем обзоре мы утверждаем, что, хотя «типичный» фенотипический результат генома человека можно предсказать, гораздо труднее предсказать фактический результат для конкретного человека. Мы выделяем три причины этого. Во-первых, на исход мутаций могут влиять случайные (стохастические) процессы. Во-вторых, генетическая изменчивость, присутствующая в одном поколении, может влиять на фенотипические признаки в следующем поколении, даже если люди не наследуют эту изменчивость. В-третьих, окружающая среда, с которой сталкивается одно поколение, может влиять на фенотипическую изменчивость в следующем поколении. Этот вклад в фенотипическую изменчивость уже давно оценили количественные генетики, хотя только недавно они были изучены на молекулярном уровне. Взятые вместе, они означают, что во многих случаях генотипы индивидуумов и среда, с которой они сталкиваются, могут быть недостаточными для определения их фенотипов. Потребуется более комплексная модель генотип-фенотип, чтобы делать точные прогнозы о биологии людей.
Потребуется более комплексная модель генотип-фенотип, чтобы делать точные прогнозы о биологии людей.
© 2012 The Authors Journal. © FEBS, 2012.
Похожие статьи
- Поиск ассоциаций генотип/фенотип и сканирование фенотипа.
Джонс Р., Пембри М., Голдинг Дж., Херрик Д. Джонс Р. и соавт. Педиатр Перинат Эпидемиол. 2005 г., июль; 19 (4): 264–75. doi: 10.1111/j.1365-3016.2005.00664.x. Педиатр Перинат Эпидемиол. 2005. PMID: 15958149 Обзор.
- От генотипа к фенотипу: уроки модельных организмов для генетики человека.
Ленер Б. Ленер Б. Нат Рев Жене. 2013 март; 14(3):168-78. дои: 10.1038/nrg3404. Epub 2013 29 января. Нат Рев Жене. 2013. PMID: 23358379 Обзор.
- Важность адаптации и взаимодействий генотип × окружающая среда в тропических системах разведения говядины.

Нора HM. Берроу ХМ. Животное. 2012 май; 6 (5): 729-40. doi: 10.1017/S175173111200002X. Животное. 2012. PMID: 22558921 Обзор.
- Как продолжительность жизни формирует эпигенотип внутри и между поколениями.
Уайтлоу, Северная Каролина, Уайтлоу Э. Уайтлоу, Северная Каролина, и др. Хум Мол Жене. 2006 г. 15 октября; 15 Спецификация № 2: R131-7. дои: 10.1093/hmg/ddl200. Хум Мол Жене. 2006. PMID: 16987876 Обзор.
- Прогнозирование фенотипической изменчивости по генотипам, фенотипам и их комбинации.
Бурга А., Ленер Б. Бурга А. и др. Курр Опин Биотехнолог. 2013 авг; 24 (4): 803-9. doi: 10.1016/j.copbio.2013.03.004. Epub 2013 26 марта. Курр Опин Биотехнолог. 2013.
 PMID: 23540420
Обзор.
PMID: 23540420
Обзор.
Посмотреть все похожие статьи
Цитируется
- Метаболическое фенотипирование морских гетеротрофов на рефакторинговых средах выявляет разнообразные метаболические адаптации и стратегии образа жизни.
Форкьелли Э., Шер Д., Сегре Д. Форкиелли Э. и др. mSystems. 2022 г., 30 августа; 7(4):e0007022. doi: 10.1128/msystems.00070-22. Epub 2022 20 июля. mSystems. 2022. PMID: 35856685 Бесплатная статья ЧВК.
- Нелинейный путь от дисфункции гена к генетическому заболеванию: уроки мышиной модели MICPCH.
Мукерджи К., ЛаКонте ЛЬЮ, Шривастава С. Мукерджи К. и др. Клетки. 2022 28 марта; 11 (7): 1131. doi: 10.3390/ячейки11071131. Клетки. 2022. PMID: 35406695 Бесплатная статья ЧВК.
 Обзор.
Обзор. - Клиническая, биохимическая и генетическая гетерогенность у пациентов с глутаровой ацидурией II типа.
Али А., Альмесмари ФСА, Дахури Н.А., Салех Али А.М., Алдханхани МААМА, Виджаян Р., Аль Тенайджи А., Аль Шамси А., Хертекант Дж., Аль Джасми Ф. Али А и др. Гены (Базель). 2021 27 августа; 12 (9): 1334. doi: 10.3390/genes12091334. Гены (Базель). 2021. PMID: 34573316 Бесплатная статья ЧВК.
- Дислексия развития: вопросы окружающей среды.
Теодориду Д., Христодулидес П., Закопулу В., Сырроу М. Теодориду Д. и соавт. наук о мозге. 2021 13 июня; 11 (6): 782. doi: 10.3390/brainsci11060782. наук о мозге. 2021. PMID: 34199166 Бесплатная статья ЧВК.
- Геномная изменчивость, способность к развитию и парадокс психических заболеваний.

 edu.
edu. 1542/пед.2018-1099Г
1542/пед.2018-1099Г
 , Дэй С., Рем Х.Л., Бакстер С.
Калешу С. и др.
Сердце. 2010 октябрь; 96(20):1669-75. doi: 10.1136/hrt.2009.1
, Дэй С., Рем Х.Л., Бакстер С.
Калешу С. и др.
Сердце. 2010 октябрь; 96(20):1669-75. doi: 10.1136/hrt.2009.1 и соавт.
БМС Педиатр. 2021 6 сентября; 21 (1): 387. doi: 10.1186/s12887-021-02830-w.
БМС Педиатр. 2021.
PMID: 34488686
Бесплатная статья ЧВК.
и соавт.
БМС Педиатр. 2021 6 сентября; 21 (1): 387. doi: 10.1186/s12887-021-02830-w.
БМС Педиатр. 2021.
PMID: 34488686
Бесплатная статья ЧВК.
 PMID: 23540420
Обзор.
PMID: 23540420
Обзор. Обзор.
Обзор.