Реактивное и проактивное мышление — разница, основные черты
получитебесплатно
Проактивное мышление как понятие впервые было использовано В. Франклом в книге «Человек в поисках смысла». По Франклу таким мышлением обладает личность, которая полностью управляет своей жизнью и отвечает за все возникающие ситуации. А популярный американский эксперт по вопросам управления С. Кови назвал проактивность одним из главных навыков по достижению успеха в жизни. Сейчас этот термин, кроме психологии, используется в управлении персоналом, IT-сфере, менеджменте.
Реактивное и проактивное мышление – в чем разница
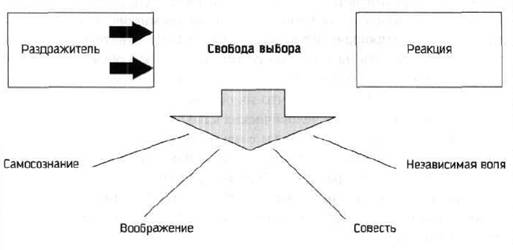
Реактивность и проактивность – два совершенно противоположных типа мышления. В их основе лежит реакция человека на определенное внешнее воздействие. Люди с реактивным типом мышления реагируют автоматически, не задумываясь, на возникшую ситуацию. Проактивное мышление между стимулирующим воздействием и реакцией содержит свободный выбор – каким образом человек будет реагировать на внешний раздражитель. Такие люди берут судьбу в свои руки, а не просто «плывут по течению». Они инициативны, самостоятельно ищут решения, а не ждут указаний, поэтому их обычно ценят работодатели.
Такие люди берут судьбу в свои руки, а не просто «плывут по течению». Они инициативны, самостоятельно ищут решения, а не ждут указаний, поэтому их обычно ценят работодатели.
Реактивный тип сначала ждет, пока произойдет событие, и только после этого начинает действовать.
Преимущества проактивного подхода к ситуациям
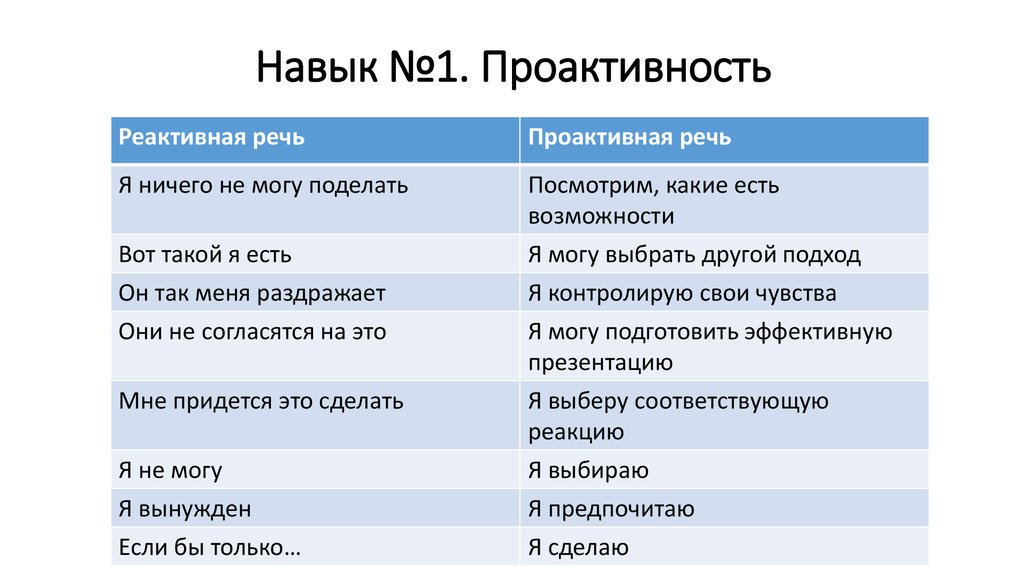
В отличие от человека, который реактивно реагирует на обстоятельства и привык бездействовать, проактивная личность уверенно добивается результатов. Даже речь таких людей имеет кардинальные отличия. Если от обладателя реактивного мышления часто можно услышать фразы «Я не могу», «Я не знаю – это сложно», «Если бы только…», то в речи проактивного человека больше присутствует «Я научусь», «Я узнаю», «Это мое решение».
Вот такими качествами обладает человек с проактивным типом мышления:
- возможности создает сам, а не ожидает подходящего случая;
- сознательно управляет событиями своей жизни;
- всегда имеет выбор при решении любой проблемы;
- ориентируется на принципы и ценности во время принятия решений;
- ищет альтернативные решения, используя творческий подход и креативные методы;
- обладает независимой от обстоятельств волей.

Основные черты проактивных компаний
Компании, как и люди, также бывают проактивные и реактивные. Реактивные компании реагируют на внешние воздействия после их проявления. А проактивность компаний заключается в прогнозировании возможных влияний и работы на их предупреждение. Проактивный бизнес управляет своей судьбой в максимально доступных ему рамках. Он старается менять то, что возможно изменить, или приспосабливается к тому, что не подлежит изменениям.
Одна из самых важных задач, которую постоянно решают компании с проактивной моделью поведения – анализ и прогноз ситуации на рынке. Они следят за новыми трендами, выявляют новые потребности покупателей, выводят на рынок новые продукты.
Можно выделить такие общие черты, которые имеют проактивные компании:
- стремление к росту и развитию как у собственника, так и у сотрудников, самообучение;
- наличие долговременных целей и стратегии развития;
- формирование внутренних процессов и корпоративной среды на основе системы ценностей и принципов, наличие корпоративного духа и этики;
- гибкая система управления, рост активов компании и основных бизнес-показателей;
- соцпакет, который гарантирует справедливую оплату труда и соцзащиту;
- соучастие сотрудников в составлении и достижении планов по прибыли, прямая связь зарплаты персонала и успехов компании.

Проактивный менеджмент в бизнесе
Понятие проактивности используется и в управлении бизнесом. Появился термин «проактивный менеджмент». Руководители компаний, подразделений и отделов также обладают одним из рассматриваемых типов мышления, соответственно, их стиль управления относится к проактивному или реактивному. Проактивный менеджмент – это качественно новый подход к управлению компанией/отделом в жестких условиях современного рынка. Он подразумевает руководство фактически в режиме реального времени с молниеносным принятием решений.
Менеджеры высшего звена для успешного управления организацией должны обладать проактивностью. На практике такой руководитель всегда предвидит события, ищет благоприятные возможности для бизнеса, стремится к переменам и активно внедряет инновации. Умеет правильно расставлять приоритеты в работе.
Отсутствие проактивности у управленца означает, что решения могут быть запоздалыми, в виде ответов на сложившиеся обстоятельства. Руководитель этого типа принимает решения исходя из анализа полученной информации и предыдущего опыта решения подобных ситуаций, ему постоянно не хватает времени. А проактивный менеджер к собственному опыту добавляет еще оценку возможных перспектив. Любое его решение рассматривается в связке с долгосрочными целями. Проактивный менеджмент можно охарактеризовать двумя словами – предвидеть и предотвратить.
Руководитель этого типа принимает решения исходя из анализа полученной информации и предыдущего опыта решения подобных ситуаций, ему постоянно не хватает времени. А проактивный менеджер к собственному опыту добавляет еще оценку возможных перспектив. Любое его решение рассматривается в связке с долгосрочными целями. Проактивный менеджмент можно охарактеризовать двумя словами – предвидеть и предотвратить.
Есть различия и в подходе к решению задач. Руководитель с проактивной позицией мыслит стратегически, а реактивной – решает всегда тактические задачи.
Но, нужно понимать, что проактивный менеджмент не должен быть единственной концепцией при управлении бизнесом. Есть множество проблем, которые требуют реактивного мышления. Нужно соблюдать баланс между этими двумя подходами.
Как правильно подбирать персонал
Как HR-специалист может использовать понятия проактивности/реактивности при отборе персонала? Уже доказано преимущество проактивных сотрудников, которые отличаются активностью и ответственностью. Если одну и ту же сложную задачу дать решить реактивному и проактивному работнику, то их процессы решения и результаты будут сильно отличаться. Реактивный будет искать причины, как бы задание не делать и при этом избежать ответственности. А проактивный будет самообучаться, искать все возможные решения и выберет из них оптимальное.
Если одну и ту же сложную задачу дать решить реактивному и проактивному работнику, то их процессы решения и результаты будут сильно отличаться. Реактивный будет искать причины, как бы задание не делать и при этом избежать ответственности. А проактивный будет самообучаться, искать все возможные решения и выберет из них оптимальное.
Поэтому, при проведении собеседования менеджер по персоналу пытается выяснить, каким типом мышления обладает соискатель. В первую очередь, реактивного претендента выдадут фразы. Можно попробовать вывести его из равновесия и посмотреть на реакцию. Еще один способ – предложить пройти специальный тест.
Это не значит, что людей с реактивным мышлением не нужно брать на работу. Просто им не подходят должности, где нужны инициатива, креативность и высокий уровень ответственности.
Проактивность в маркетинге
Рассмотрим понятие проактивности в маркетинге. Обычно маркетологи использовали информацию для измерения прошлых показателей. Но для успешных кампаний нужно уметь предсказывать действия потенциальных клиентов.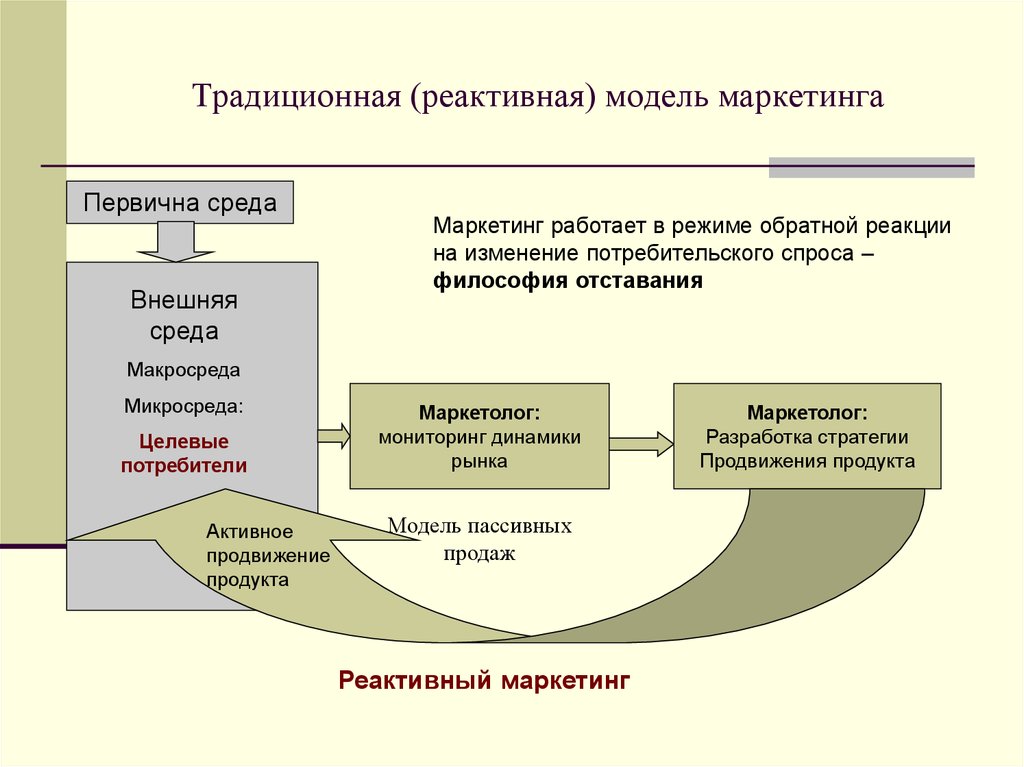 На сцену выходит проактивный маркетинг – прогнозирование скрытых потребностей покупателей и разработка соответствующих УТП (офферов).
На сцену выходит проактивный маркетинг – прогнозирование скрытых потребностей покупателей и разработка соответствующих УТП (офферов).
Проактивный маркетолог должен использовать не только доступную информацию, но и скрытые данные о поведении и интересах пользователей. Это позволяет предвидеть поведенческие характеристики и будущие предпочтения целевой аудитории. Чтобы быть проактивным, нужно придерживаться таких правил:
- для контроля данных нужно использовать режим реального времени. Это позволит быстро реагировать на негативные тенденции и перенастраивать кампанию;
- отправка email-рассылок должна работать на опережение и учитывать будущие желания пользователей. Используйте оптимальное время для рассылки, динамический контент и максимально узкие целевые аудитории;
- применяйте персональный подход и знание аудитории для прогноза, что может в дальнейшем заинтересовать покупателей в тех или иных условиях;
- с помощью сегментации на активных и пассивных пользователей предугадывайте отток заранее и возвращайте потерянных клиентов.
 Продуманная рассылка отлично с этим справляется;
Продуманная рассылка отлично с этим справляется; - помогайте пользователям найти нужный контент/товар/услугу еще до того момента, как они задумаются об этом.
Как стать проактивным – советы Стивена Кови
Благодаря советам известного эксперта можно проанализировать свое мышление и реакции, а затем попробовать изменить стереотипы поведения. Над чем стоит поработать?
- Проанализируйте различные области своей жизни и распределите на две части или два круга, как предлагает Кови. В один круг (круг Забот) нужно определить то, что нас тревожит, но мы не можем на это повлиять. Второй круг (круг Влияния) должен содержать то, что мы можем контролировать. Определите, в какой из кругов попали самые важные для вас сферы жизни. Если они попали в Заботы – вы реактивная личность, а если в круг Влияния – вы проактивны.
- Выполните анализ своей речи на предмет фраз «Я могу»/«Я не могу», что у вас преобладает?
- Смоделируйте ситуацию, в которой вы можете повести себя реактивно.
 Представьте, как бы выглядела в этом случае проактивная реакция и старайтесь в будущем придерживаться такого поведения.
Представьте, как бы выглядела в этом случае проактивная реакция и старайтесь в будущем придерживаться такого поведения. - Выберите насущную проблему и определите, насколько она вами контролируется. Представьте, как вы будете ее решать, если она будет в круге Влияния. Начните это делать.
- Помните о том, что в любой ситуации есть выбор, который нужно подкреплять действиями.
- Смотрите на каждое событие как на новые возможности, которые приближают вас к цели. Учитесь мыслить и вести себя проактивно. Это приведет вас к успеху.
В поведении любого человека есть моменты как реактивного, так и проактивного мышления. В каких-то ситуациях один и тот же человек может мыслить реактивно, а в других проактивно. Просто нужно стремиться, чтобы проактивных решений было больше.
Подведем итоги. Проактивность дает преимущества в вопросах управления, маркетинга, помогает в прогнозировании ситуаций на рынке и достижении целей. Проактивные компании гораздо устойчивее в период кризиса, на несколько шагов опережают конкурентов.
получитебесплатно
Что такое LTV
Как поставить план продаж?
Что такое лид, как и для чего его отслеживать
Как повысить конверсию в продажах
Эффективный руководитель: кто он и как им стать
Проактивный и реактивный подходы к жизни: ищем проблему в себе
Прочитано: 34 427
Проактивный и реактивный? Вроде бы какая разница, если в обоих словах спрятался «активный» термин. А ведь большая! Реактивный и проактивный подход к жизни – настолько различаются, что нужно не только понимать разницу между ними, но и стремится к преобладанию одной поведенческой схемы. Но вот какой?
Проактивное и реактивное мышление: что важнее
Первым делом разбираемся в терминологии.
Проактивный человек – это тот, кто опирается только на себя. При любых событиях он оценивает свои действия, свои поступки и свои решения. Влияние окружающего мира для него незначительно и сведено к минимуму.
Влияние окружающего мира для него незначительно и сведено к минимуму.
Реактивная личность, наоборот, склонна винить любые обстоятельства, которые встали у нее на пути. Хоть плохую погоду, хоть коллег, хоть детей. Всегда есть какой-то источник помех, который помешал добиться результата.
Если говорить более научным языком, то реактивный и проактивный подход различаются опорой на ресурсы. Проактивный человек видит источником ресурсов себя, реактивный находит их вне.
Из терминологии понятно, что реактивное и проактивное поведение, несмотря на красивый общий корень слова, сильно различаются. Что дальше?
Проактивные и реактивные люди: достижение результатов
Реактивная и проактивная модель поведения определяет все.
Общение в семье.
Поведение на работе.
Предпосылки к карьерному росту.
Склонность к планированию.
Внедрение привычек.
Любая сфера жизни зависит от выбранной схемы поведения.
Все успешные люди «идут и делают».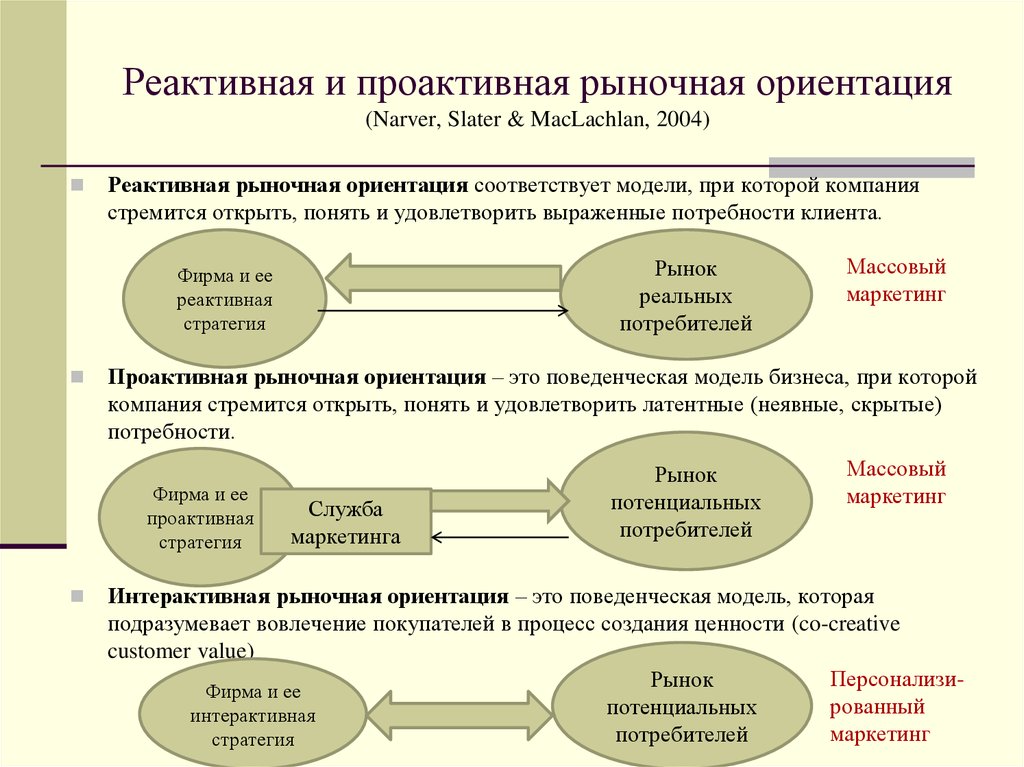 Они ориентированы на результат, а значит проактивны.
Они ориентированы на результат, а значит проактивны.
Они просчитывают ходы наперед, оценивают риски и всегда имеют альтернативный план поведения. Им это нужно, чтобы никакие внешние факторы не повлияли на их движение.
Проактивность – это в первую очередь ответственность перед собой и принятыми решениями. А уж потом активность в плане осуществления замыслов.
Проактивный или реактивный: тест
Проактивная/реактивная позиция легко оценивается при помощи несложного теста. В нем нужно выбрать фразы, которые человек использует в разных ситуациях.
Нужно примерить оба варианта и выбрать предпочтительный. И оценить результаты.
Не стоит стремиться выбирать те сочетания, которые никогда не мелькают в голове и не звучат вслух. Это не верно. Да и не поможет дать истинное определение типа поведения.
| Проактивный | Реактивный |
| Я буду стремиться это изменить | Вряд ли с этим вообще можно что-то сделать |
| Я изменю их мнение | Их вряд ли возможно переубедит |
| Мне не очень нравятся люди, с которыми я работаю, но не так сильно, чтобы я принимал это близко к сердцу | Меня раздражают мои коллеги |
| Я иду на работу | Я вынужден идти на работу |
| Я решил (а), что поступлю именно так | Мне придется поступить так из-за того, что… |
| Я найду время, которое посвящу этим делам | Я бы помог, но у меня нет времени |
| Я придумаю, где найти средства для старта проекта | У меня ограничены финансовые возможности, я не смогу начать этот проект |
| Странно, что это мало кого интересует, что сделать для того, чтобы это приносило пользу? | Никому это не нужно, ну и я не буду ничего делать |
Мне нужны связи. Я придумаю, где их найти Я придумаю, где их найти | Здесь необходимы определенные связи. У меня их нет |
| Я докажу, что лучше меня никто не сделает эту работу | Мне не доверят эту работу |
Что делать, если в списке есть «реактивные» фразы?
Работать с этим.
Есть простой алгоритм повышения проактивности, и если ему следовать то можно много добиться.
7 шагов к проактивной личности
Каждый из нас имеет черты и проактивности, и реактивности. Это просто манера поведения, которая легко меняется.
Хорошо, не легко. Но меняется.
Первое, что нужно – оценивать себя в каждой возможной ситуации:
- Реактивно я себя веду или проактивно?
- Какой правильный алгоритм поведения?
- Что я могу сделать для повышения проактивности?
Это первый шаг.
Дальше:
- Самоанализ. Оцените не только ситуацию, но и жизнь в целом. Окружение, которое, как известно, нас формирует. Привычки близких. Типичные проблемы.
 Постоянные дела. Задачи, требующие решения.
Постоянные дела. Задачи, требующие решения. - Работа с задачами. После самоанализа выберите самую важную задачу и сделайте по ней ряд действий. Среди них должен быть план достижения цели. Рассказ о своем плане близким.
Взятые вслух обязательства заставляют нас действовать проактивно.
Изучение опыта других. Движение к цели.
- План Б. Обязательно проработайте подводные камни и возможные препятствия по выбранной задаче. Наметьте линии поведения при возникновении самых сложных.
- Решение проблем. Очень важный пункт, гласящий, что проблемы нужно решать, а не избегать их. Любые. Есть проблема – не стоит копаться в ней – ее надо просто решить. Самым эффективным способом.
- Расставляйте приоритеты. Задачи лучше решать последовательно, а не одновременно. Начинать стоит неизменно с лягушки, а потом и задачи меньшей важности.
- Опережайте. Думайте наперед. Если по прогнозу обещают дождь, с вечера приготовьте зонтик.
 И так в любых ситуациях. Чуть-чуть действий наперед, и результативность каждого дня начнет расти.
И так в любых ситуациях. Чуть-чуть действий наперед, и результативность каждого дня начнет расти.
Итак, получилось 1+6 шагов к проактивной жизни. Всего 7.
Несложных и доступных любому.
Осталось их только сделать.
Вместо вывода
Суть проактивного и реактивного подхода к жизни понятна.
Одни действуют.
Вторые стонут.
Кто достигает цели, комментировать не нужно.
Осталось только решить, какой путь ваш. И привести примеры собственного проактивного и реактивного поведения, если удастся их поймать в текущих делах. Простой анализ, а получится ли? Пишите в комментариях.
Интересно почитать:
Реакции в бензильном положении
Электрофильное ароматическое замещение
Реакции в бензильном положении Бензильное положение довольно реакционноспособно и представляет собой полезный синтетический инструмент для получения многих ароматических соединений. Причиной такой реакционной способности является резонансная стабилизация бензильного углерода независимо от того, идет ли реакция по ионному или радикальному механизму.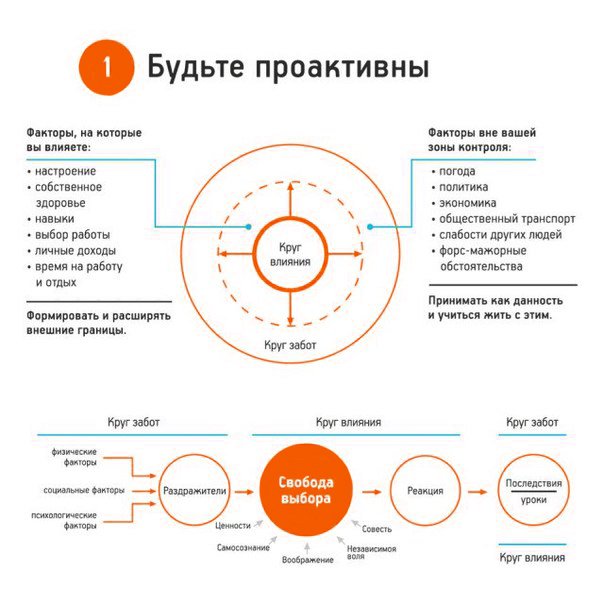 Мы обсудим каждый из них в следующих разделах.
Мы обсудим каждый из них в следующих разделах.
Возвращаясь к реакциям нуклеофильного замещения и элиминирования, можно вспомнить, что бензильные субстраты легко вступают в реакции S N 1 , S N 2 , E и E2 реакции . Для механизмов S N 2 и E2 это просто вопрос наличия сильного основания/нуклеофила и свободного атома углерода:
Реакции 1 и E1 объясняются резонансной стабилизацией бензильного карбокатиона образуется на этапе определения скорости:
Помните, что карбокатионы sp 2 -гибридизированы и пустая орбиталь положительно заряженного углерода хорошо выровнена с 9000 7 орбиталями ароматического углерода. система , которая делает катион резонансно-стабилизированным:
Не путайте бензильный карбокатион с фенилкарбокатионом. Да, они оба sp 2 углерода, но в отличие от бензильного углерода, t положительный заряд фенильного катиона является результатом пустой s p 2 орбитали, которая расположена перпендикулярно сопряженной ароматической системе и не может быть стабилизирована резонансом:
Вот почему, например, арил- и винилгалогениды подвергаются алкилированию Фиделя-Крафтса:
Бромирование также можно проводить с использованием N-бромсукцинимида ( NBS ), как и при аллильном бромировании:
снова объясняется его резонансной устойчивостью. Помните, что радикалы также могут быть стабилизированы резонансом:
Помните, что радикалы также могут быть стабилизированы резонансом:
Сильные окислители, такие как KMnO 4 и Na 2 Cr 2 O 7 окисляют первичный или вторичный бензильный углерод до карбоксильной группы. Единственное требование здесь состоит в том, чтобы имел по крайней мере один водород на бензильном углероде . Следовательно, окисление работает только для первичных и вторичных спиртов:
Обратите внимание, что даже для более длинных алкильных групп оставшиеся атомы углерода отщепляются при окислении и образуются бензойные кислоты.
Мягкий окислитель может быть использован для окисления бензиловых спиртов до соответствующих кетонов в тщательно подобранных условиях:
— Реакции Кишнера:
Механизм и более подробная информация об этих реакциях описаны в этой статье.
Обратите внимание, что другие кетоны восстанавливаются до спиртов и только арилкетоны могут быть восстановлены до метиленовой группы каталитическим гидрированием (H 2 + Pt или Pd/C):
Я еще хотел бы добавить сюда восстановление нитрогруппы бензольного кольца:
Эта реакция важна, так как нет прямого пути превращения бензола в анилин который является важным предшественником в препарате многих ароматических соединений.
Он также используется для получения солей арендиазония, которые также являются отличным источником для проведения ароматических превращений.
Бензильное окисление является отличным способом получения замещенной бензойной кислоты s, так как карбоксильная группа не может быть добавлена непосредственно путем реакции электрофильного ароматического замещения. окислением:
окислением:
Кроме того, бензол может быть превращен в орто-, пара- или метаактивированное кольцо в зависимости от порядка этих реакций.
Например, как можно получить p -Нитробензойную кислоту из бензола?
Проблема в том, что обе группы являются метадиректорами.
Однако мы можем сначала алкилировать бензольное кольцо с последующим нитрованием и окислением полученных p — Нитротолуол в p — Нитробензойная кислота:
Обратите внимание, что в обратном порядке требуется алкилирование нитробензола по Фриделю-Крафтсу, а реакции Фриделя-Крафтса обычно не работают с дезактивированными кольцами. Но даже , если мы притворимся, что они делают , все равно дает нежелательный мета-продукт:
Итак, как тогда приготовить мета-нитробензойную кислоту?
Ну, так как метилирование нитробензола не работает, то нужно идти другим путем, т. е. сначала установить карбоксильную группу, а потом уже делать нитрование, которое будет происходить в метаположении, так как карбонильная группа является метадиректором :
е. сначала установить карбоксильную группу, а потом уже делать нитрование, которое будет происходить в метаположении, так как карбонильная группа является метадиректором :
Они связаны с синтезом дизамещенных бензолов, и если вам нужны дополнительные практические задачи по этому вопросу, вы можете найти их здесь:
Синтез ароматических соединений из бензола
Вы также можете попробовать решить эти многошаговые задачи, которые включают в себя много ароматической химии. Я поставлю один здесь, а вы проверите остальные здесь:
Практические задачи по многостадийному синтезу органической химии
Подробнее об электрофильном ароматическом замещении
- Ацилирование Фриделя-Крафтса с практическими задачами
- Алкилирование бензола путем ацилирования-восстановления
- Орто-пара-мета в EAS с практическими проблемами
- Орто-пара и мета в дизамещенных бензолах
- Почему галогены являются орто-, пара-директорами, но при этом дезактиваторами?
- Ограничения электрофильных реакций ароматического замещения
- Ориентация в бензольных кольцах с более чем одним заместителем
- Синтез ароматических соединений из бензола
- Соли арендиазония в электрофильном ароматическом замещении
- Реакции в бензильном положении
- Нуклеофильное ароматическое замещение
- Практические проблемы нуклеофильного ароматического замещения
Ароматическая реакционная способность
Реакции ароматического замещения |
|---|
Замечательная стабильность ненасыщенного углеводородного бензола обсуждалась в предыдущем разделе. Химическая реакционная способность бензола отличается от реакционной способности алкенов тем, что реакции замещения предпочтительнее реакций присоединения, как показано на следующей диаграмме (некоторые сопоставимые реакции циклогексена показаны в зеленой рамке).
Химическая реакционная способность бензола отличается от реакционной способности алкенов тем, что реакции замещения предпочтительнее реакций присоединения, как показано на следующей диаграмме (некоторые сопоставимые реакции циклогексена показаны в зеленой рамке).
Наблюдалось множество других реакций замещения бензола, пять наиболее полезных из них перечислены ниже (хлорирование и бромирование — наиболее распространенные реакции галогенирования). Поскольку реагенты и условия, используемые в этих реакциях, являются электрофильными, эти реакции обычно называют Электрофильное ароматическое замещение . Катализаторы и сореагенты служат для создания сильных электрофильных частиц, необходимых для осуществления начальной стадии замещения. Конкретный электрофил, который, как считается, действует в каждом типе реакции, указан в правой колонке.
| Тип реакции | Типичное уравнение | Электрофил E (+) | ||||
|---|---|---|---|---|---|---|
| Галогенирование: | С 6 Н 6 | + Cl 2 & heat FeCl 3 catalyst | —— > | C 6 H 5 Cl + HCl Chlorobenzene | Cl (+) or Br (+) | |
| Нитрование: | C 6 H 6 | + HNO 3 и тепло H 2 SO 4 катализатор | — — 0324 | C 6 H 5 NO 2 + H 2 O Нитробензол | NO 2 (+) | |
| Сульфирование: | C 6 H 6 | + H 2 SO 4 + SO 3 & HEAT | — > | C 3 — > | C 9. 9. 9. 9. 9. 9. 9. 9.. H 2 O 9. 9. 9. 9. 9. 9. 9.. H 2 O Бензолсульфокислота | SO 3 H (+) |
| Алкилирование: Фридель-Крафтс | C 6 H 6 | + R -CL & HEAT ALCL 3 Катализатор | —> | C 6 H 5 -1920.1920 29999999999999999999999999999999999999999999999.19.19.19.19.19.19.19.19.19.19.19.19.19.19.19.19.19.19.19.19.19.19.19.9.1920 — | C 6 H 5 | . (+)|
| Ацилирование: Фридель-Крафтс | С 6 Н 6 | + RCOCl и тепло AlCl | —— > | C 6 H 5 COR 3 + 0 HCl 9 кетон 9029 | РКО (+) | |
1.
 Механизм реакций электрофильного замещения бензола
Механизм реакций электрофильного замещения бензолаДля этих реакций электрофильного замещения был предложен двухстадийный механизм. На первом, медленном или определяющем скорость, этапе электрофил образует сигма-связь с бензольным кольцом, образуя положительно заряженный бензониевый промежуточный продукт . На втором, быстром этапе из этого промежуточного соединения удаляется протон с образованием замещенного бензольного кольца. Следующая иллюстрация, состоящая из четырех частей, показывает этот механизм реакции бромирования. Также можно просмотреть анимированную диаграмму.
Бромирование бензола – пример электрофильного ароматического замещения
| ||||
Этот механизм электрофильного ароматического замещения следует рассматривать в контексте с другими механизмами, включающими промежуточные карбокатионы. К ним относятся реакции S N 1 и E1 алкилгалогенидов и реакции присоединения кислот Бренстеда к алкенам.
Подводя итог, можно сказать, что при образовании промежуточных соединений карбокатионов можно ожидать, что они будут реагировать в дальнейшем по одному или нескольким из следующих режимов:
1. Катион может связываться с нуклеофилом с образованием продукта замещения или присоединения.
2. Катион может переносить протон на основание с образованием двойной связи.
3. Катион может перегруппироваться в более стабильный карбокатион, а затем прореагировать по модулю №1 или №2.
S N 1 и Е1 реакции являются соответствующими примерами первых двух режимов реакции. Вторая стадия реакций присоединения алкенов протекает по первому типу, и в любой из этих трех реакций может наблюдаться молекулярная перегруппировка, если образуется исходный неустойчивый карбокатион. Промежуточный карбокатион при электрофильном ароматическом замещении (ион бензония) стабилизируется за счет делокализации заряда (резонанс), поэтому он не подвергается перегруппировке. В принципе, он может реагировать либо по способу 1, либо по способу 2, но энергетическое преимущество реформирования ароматического кольца приводит к исключительной реакции по способу 2 (9).0555 т.е. потеря протонов).
Промежуточный карбокатион при электрофильном ароматическом замещении (ион бензония) стабилизируется за счет делокализации заряда (резонанс), поэтому он не подвергается перегруппировке. В принципе, он может реагировать либо по способу 1, либо по способу 2, но энергетическое преимущество реформирования ароматического кольца приводит к исключительной реакции по способу 2 (9).0555 т.е. потеря протонов).
2. Реакции замещения производных бензола
Когда замещенные соединения бензола подвергаются реакциям электрофильного замещения, описанным выше, необходимо учитывать две взаимосвязанные особенности:
I. Первая — это относительная реакционная способность соединения по сравнению с самим бензолом. Эксперименты показали, что заместители в бензольном кольце могут сильно влиять на реакционную способность.
Например, гидроксильный или метоксизаместитель увеличивает скорость электрофильного замещения примерно в десять тысяч раз, как показано на примере анизола в виртуальной демонстрации (выше).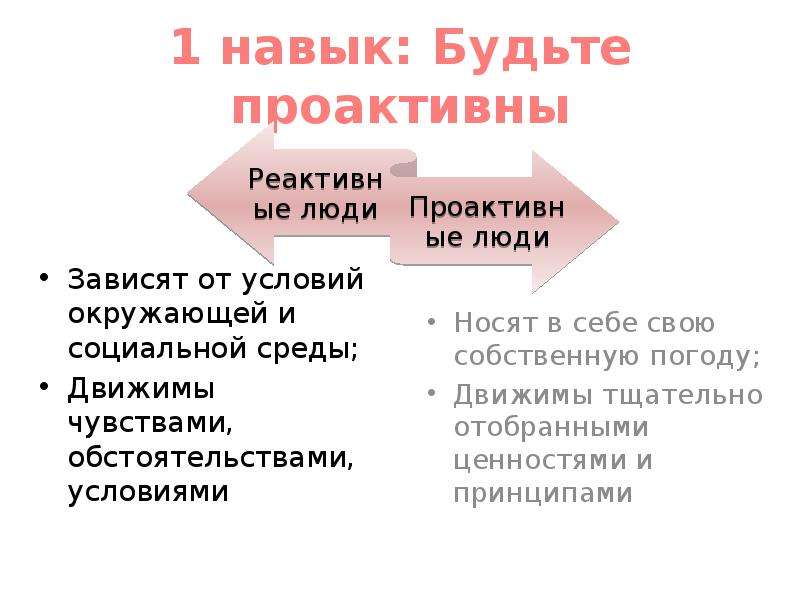 Напротив, нитрозаместитель снижает реакционную способность кольца примерно на миллион. это активация или дезактивация бензольного кольца в сторону электрофильного замещения может коррелировать с электронодонорным или электроноакцепторным влиянием заместителей, измеряемым молекулярными дипольными моментами. На следующей диаграмме мы видим, что электронодонорные заместители (синие диполи) активируют бензольное кольцо в направлении электрофильной атаки, а электроноакцепторные заместители (красные диполи) деактивируют кольцо (делают его менее реактивным к электрофильной атаке).
Напротив, нитрозаместитель снижает реакционную способность кольца примерно на миллион. это активация или дезактивация бензольного кольца в сторону электрофильного замещения может коррелировать с электронодонорным или электроноакцепторным влиянием заместителей, измеряемым молекулярными дипольными моментами. На следующей диаграмме мы видим, что электронодонорные заместители (синие диполи) активируют бензольное кольцо в направлении электрофильной атаки, а электроноакцепторные заместители (красные диполи) деактивируют кольцо (делают его менее реактивным к электрофильной атаке).
Влияние заместителя на реакционную способность бензольного кольца можно объяснить взаимодействием двух эффектов:
Первый индуктивный эффект заместителя. Большинство элементов, кроме металлов и углерода, имеют значительно большую электроотрицательность, чем водород. Следовательно, заместители, в которых атомы азота, кислорода и галогена образуют сигма-связи с ароматическим кольцом, вызывают индуктивный отвод электронов, что дезактивирует кольцо (левая диаграмма ниже).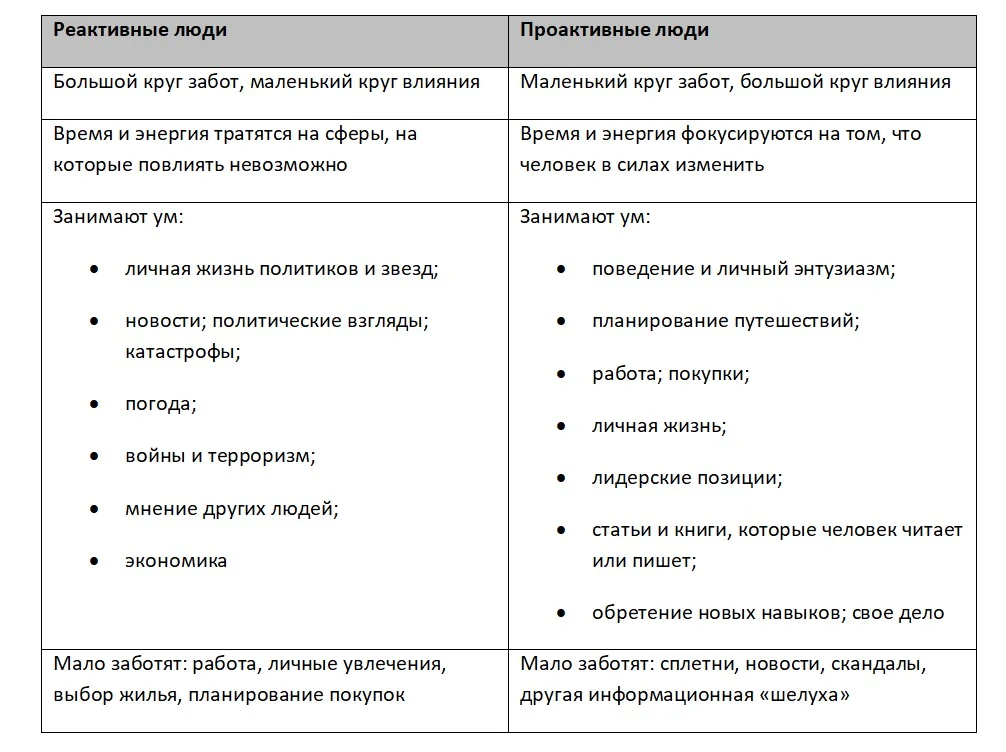
Второй эффект является результатом сопряжения заместительной функции с ароматическим кольцом. Это конъюгативное взаимодействие облегчает передачу или удаление электронной пары к бензольному кольцу или от него способом, отличным от индуктивного сдвига. Если атом, связанный с кольцом, имеет одну или несколько несвязывающих пар электронов валентной оболочки, как азот, кислород и галогены, электроны могут течь в ароматическое кольцо за счет p-π-сопряжения (резонанса), как на средней диаграмме. Наконец, полярные двойные и тройные связи, сопряженные с бензольным кольцом, могут оттягивать электроны, как на правой диаграмме. Обратите внимание, что в резонансных примерах показаны не все вкладчики. В обоих случаях распределение заряда в бензольном кольце наибольшее в орто- и пара-позициях по отношению к заместителю.
В случае активирующих групп азота и кислорода, показанных в верхнем ряду предыдущей диаграммы, донорство электронов за счет резонанса доминирует над индуктивным эффектом, и эти соединения проявляют исключительную реакционную способность в реакциях электрофильного замещения. Хотя атомы галогенов имеют несвязывающие пары валентных электронов, которые участвуют в p-π-сопряжении, преобладает их сильный индуктивный эффект, и такие соединения, как хлорбензол, менее реакционноспособны, чем бензол. Три примера слева в нижнем ряду (на той же диаграмме) являются примерами отщепления электронов за счет сопряжения с полярными двойными или тройными связями, и в этих случаях индуктивный эффект еще больше усиливает дезактивацию бензольного кольца. Алкильные заместители, такие как метил, увеличивают нуклеофильность ароматических колец так же, как они действуют на двойные связи.
Хотя атомы галогенов имеют несвязывающие пары валентных электронов, которые участвуют в p-π-сопряжении, преобладает их сильный индуктивный эффект, и такие соединения, как хлорбензол, менее реакционноспособны, чем бензол. Три примера слева в нижнем ряду (на той же диаграмме) являются примерами отщепления электронов за счет сопряжения с полярными двойными или тройными связями, и в этих случаях индуктивный эффект еще больше усиливает дезактивацию бензольного кольца. Алкильные заместители, такие как метил, увеличивают нуклеофильность ароматических колец так же, как они действуют на двойные связи.
II. Второй фактор, который становится важным в реакциях замещенных бензолов, касается центра, в котором происходит электрофильное замещение. Поскольку монозамещенное бензольное кольцо имеет два эквивалентных орто-сайта, два эквивалентных мета-сайта и уникальный пара-сайт, при таком замещении могут образоваться три возможных структурных изомера.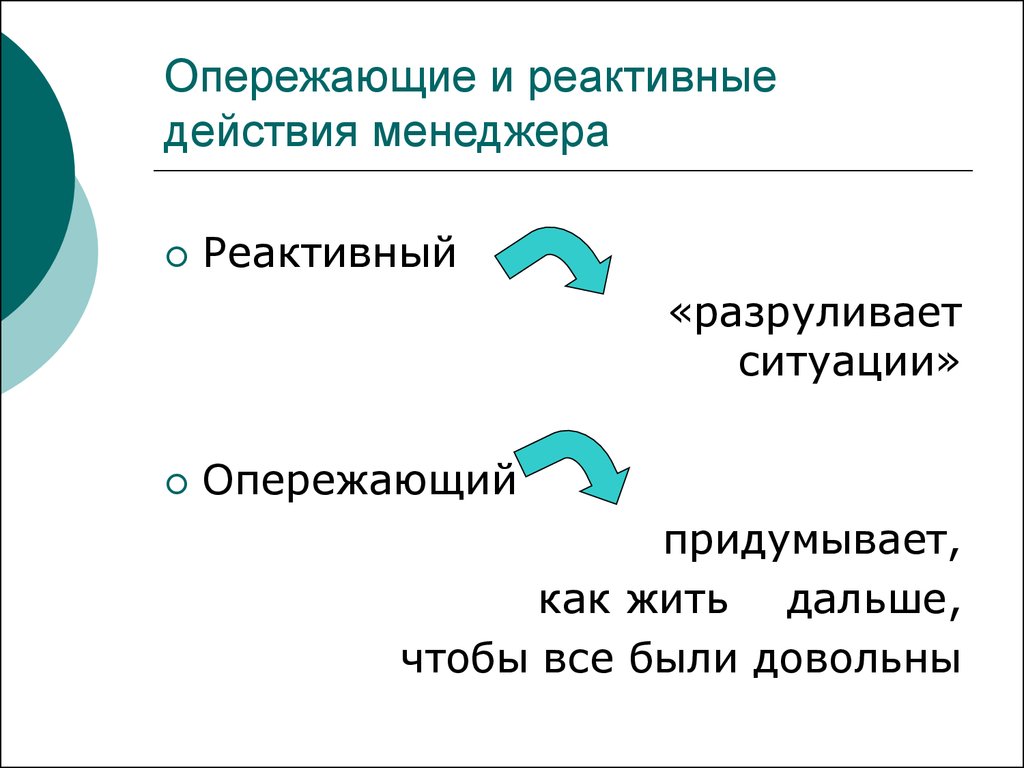 Если реакция протекает одинаково хорошо во всех доступных местах, ожидаемая статистическая смесь изомерных продуктов будет составлять 40% орто, 40% мета и 20% пара. Снова мы обнаруживаем, что природа заместителя существенно влияет на это соотношение продукта. Бромирование метоксибензола (анизола) происходит очень быстро и дает в основном пара-бромизомер, сопровождаемый 10% орто-изомера и лишь след мета-изомера. Бромирование нитробензола требует сильного нагревания и дает в качестве основного продукта мета-бромизомер.
Если реакция протекает одинаково хорошо во всех доступных местах, ожидаемая статистическая смесь изомерных продуктов будет составлять 40% орто, 40% мета и 20% пара. Снова мы обнаруживаем, что природа заместителя существенно влияет на это соотношение продукта. Бромирование метоксибензола (анизола) происходит очень быстро и дает в основном пара-бромизомер, сопровождаемый 10% орто-изомера и лишь след мета-изомера. Бромирование нитробензола требует сильного нагревания и дает в качестве основного продукта мета-бромизомер.
Некоторые дополнительные примеры распределения изомеров продукта в других электрофильных заменах приведены в таблице ниже. Здесь важно отметить, что условия реакции для этих реакций замещения не одинаковы и должны быть скорректированы в соответствии с реакционной способностью реагента C 6 H 5 -Y. Например, высокая реакционная способность анизола требует, чтобы первые две реакции проводились в очень мягких условиях (низкая температура и небольшое количество катализатора или его отсутствие). Реагент нитробензол в третьем примере очень нереакционноспособен, поэтому для осуществления этой реакции необходимо использовать довольно жесткие условия реакции.
Реагент нитробензол в третьем примере очень нереакционноспособен, поэтому для осуществления этой реакции необходимо использовать довольно жесткие условия реакции.
Y в C 6 H 5 — | % Ortho-Product | 903 %. | –О–СН 3 | Nitration | 30–40 | 0–2 | 60–70 | |
|---|---|---|---|---|---|---|---|---|
| –O–CH 3 | F-C Acylation | 5–10 | 0–5 | 90–95 | ||||
| –NO 2 | Nitration | 5–8 | 90–95 | 0–5 | ||||
| –CH 3 | Nitration | 55–65 | 1–5 | 35–45 | ||||
| –CH 3 | Sulfonation | 30–35 | 5–10 | 60–65 | ||||
| –CH 3 | F-C Acylation | 10–15 | 2–8 | 85–90 | ||||
| –Br | Nitration | 35–45 | 0–4 | 55–65 | ||||
| –Br | Chlorination | 40–45 | 5–10 | 50 –60 |
Эти наблюдения и многие другие подобные им побудили химиков сформулировать эмпирическую классификацию различных групп заместителей, обычно встречающихся в реакциях ароматического замещения. Таким образом, заместители, которые активируют бензольное кольцо в направлении электрофильной атаки, обычно направляют замещение в орто- и пара-положениях. За некоторыми исключениями, такими как галогены, дезактивирующие заместители замещают прямым замещением в мета-местоположении. Следующая таблица суммирует эту классификацию.
Таким образом, заместители, которые активируют бензольное кольцо в направлении электрофильной атаки, обычно направляют замещение в орто- и пара-положениях. За некоторыми исключениями, такими как галогены, дезактивирующие заместители замещают прямым замещением в мета-местоположении. Следующая таблица суммирует эту классификацию.
Эффекты ориентации и реакционной способности кольцевых заместителей | |||||||
|---|---|---|---|---|---|---|---|
Активирующие заместители | Дезактивирующие заместители | Дезактивирующие заместители | |||||
| –O (–) –OH –OR –OC 6 H 5 –OCOCH 3 | –NH 2 –NR 2 –NHCOCH 3 –R –C 6 H 5 | –NO 2 –NR 3 (+) –PR 3 (+) –SR 2 (+) –SO 3 H – SO 2 R | – CO 2 H – CO 2 R –CONH 2 –CHO –COR –CN | –F –Cl –Br –I –CH 2 Cl –CH=CHNO 2 | |||
Информация, обобщенная в приведенной выше таблице, очень полезна для рационализации и предсказания хода реакций ароматического замещения, но на практике большинство химиков считают желательным понимать основные физические принципы, лежащие в основе этой эмпирической классификации. Мы уже проанализировали активирующие или дезактивирующие свойства заместителей с точки зрения индуктивных и резонансных эффектов, и эти же факторы можно использовать для объяснения их влияния на ориентацию замещения.
Мы уже проанализировали активирующие или дезактивирующие свойства заместителей с точки зрения индуктивных и резонансных эффектов, и эти же факторы можно использовать для объяснения их влияния на ориентацию замещения.
Первое, что нужно признать, это то, что пропорции орто-, мета- и паразамещения в данном случае отражают относительную скорость замещения в каждом из этих сайтов. Если мы используем нитрование бензола в качестве эталона, мы можем определить скорость реакции по одному из атомов углерода как 1,0. Поскольку в бензоле шесть эквивалентных атомов углерода, общая скорость будет равна 6,0. Если таким же образом исследовать нитрование толуола, трет-бутилбензола, хлорбензола и этилбензоата, то можно определить относительные скорости орто-, мета- и пара-центров в каждом из этих соединений. Эти относительные скорости показаны (выделены красным цветом) на следующей иллюстрации, а общая скорость, указанная под каждой структурой, отражает соотношение 2:1 орто- и метасайтов к пара-положению. Общие относительные скорости реакции, отнесенные к бензолу как 1,0, рассчитываются путем деления на шесть. Очевидно, что алкильные заместители активируют бензольное кольцо в реакции нитрования, а хлорные и сложноэфирные заместители дезактивируют кольцо.
Общие относительные скорости реакции, отнесенные к бензолу как 1,0, рассчитываются путем деления на шесть. Очевидно, что алкильные заместители активируют бензольное кольцо в реакции нитрования, а хлорные и сложноэфирные заместители дезактивируют кольцо.
По таким данным скорости легко рассчитать соотношение трех изомеров замещения. Толуол дает 58,5% орто-нитротолуола, 37% пара-нитротолуола и только 4,5% мета-изомера. Увеличенная масса трет-бутильной группы препятствует атаке на орто-сайты, общая смесь продуктов включает 16% орто-, 8% мета- и 75% пара-нитропродукта. Хотя хлорбензол гораздо менее реакционноспособен, чем бензол, скорость орто- и пара-замещения значительно превышает скорость мета-замещения, что дает смесь продуктов, состоящую из 30% орто- и 70% пара-нитрохлорбензола. Наконец, сложный эфир бензойной кислоты давал преимущественно мета-нитропродукт (73%), сопровождаемый орто- (22%) и пара-изомерами (5%), как показывают относительные скорости. Эквивалентные исследования скорости и продукта для других реакций замещения приводят к аналогичным выводам. Например, электрофильное хлорирование толуола происходит в сотни раз быстрее, чем хлорирование бензола, но относительные скорости таковы, что продукты на 60% состоят из орто-хлортолуола, 39% пара и 1% мета-изомеров, соотношение аналогично наблюдаемому для нитрования.
Эквивалентные исследования скорости и продукта для других реакций замещения приводят к аналогичным выводам. Например, электрофильное хлорирование толуола происходит в сотни раз быстрее, чем хлорирование бензола, но относительные скорости таковы, что продукты на 60% состоят из орто-хлортолуола, 39% пара и 1% мета-изомеров, соотношение аналогично наблюдаемому для нитрования.
То, как конкретные заместители влияют на ориентацию электрофильного замещения бензольного кольца, показано на следующей интерактивной диаграмме. Как отмечено на начальной иллюстрации, этап, определяющий продукт в механизме замещения, является первым этапом, который также является медленным или определяющим скорость этапом. Поэтому неудивительно, что существует грубая корреляция между повышающим скорость эффектом заместителя и его влиянием на сайт. Точное влияние данного заместителя лучше всего видно, если посмотреть на его взаимодействие с делокализованным положительным зарядом на промежуточных соединениях бензонония, образующихся при связывании с электрофилом в каждом из трех мест замещения. Это можно сделать для семи репрезентативных заместителей, используя кнопки выбора под диаграммой.
Это можно сделать для семи репрезентативных заместителей, используя кнопки выбора под диаграммой.
Y– | CH 3 | Cl or Br | NO 2 | RC=O | SO 3 H | OH | NH 2 |
|---|---|---|---|---|---|---|---|
В случае алкильных заместителей стабилизация заряда наибольшая, когда алкильная группа связана с одним из положительно заряженных атомов углерода бензониевого промежуточного соединения. Это происходит только при орто- и пара-электрофильной атаке, поэтому такие заместители способствуют образованию этих продуктов. Интересно, что первичные алкильные заместители, особенно метильные, обеспечивают большую стабилизацию соседнего заряда, чем большее количество замещенных групп (обратите внимание на большую реакционную способность толуола по сравнению с трет-бутилбензолом).
Нитро (NO 2 ), сульфокислота (SO 3 H) и карбонильный (C=O) заместители имеют полный или частичный положительный заряд на атоме, связанном с ароматическим кольцом. Структуры, в которых одноименные заряды расположены близко друг к другу, дестабилизируются из-за отталкивания зарядов, поэтому эти заместители ингибируют орто- и паразамещение больше, чем метазамещение. Следовательно, мета-продукты преобладают, когда вынужденно происходит электрофильное замещение.
Галоген ( X ), OR и NR 2 9Все заместители 0019 оказывают дестабилизирующий индуктивный эффект на соседний положительный заряд из-за высокой электроотрицательности атомов заместителей. Само по себе это способствовало бы метазамещению; однако все эти атомы-заместители имеют несвязывающие пары валентных электронов, которые служат для стабилизации соседнего положительного заряда за счет пи-связи, что приводит к делокализации заряда. Следовательно, все эти заместители ведут к прямому замещению на орто- и пара-сайты. Баланс между индуктивным отщеплением электронов и p-π-сопряжением таков, что заместители азота и кислорода оказывают общее стабилизирующее влияние на бензониевый промежуточный продукт и заметно увеличивают скорость замещения; тогда как заместители галогена оказывают общее дестабилизирующее влияние.
Баланс между индуктивным отщеплением электронов и p-π-сопряжением таков, что заместители азота и кислорода оказывают общее стабилизирующее влияние на бензониевый промежуточный продукт и заметно увеличивают скорость замещения; тогда как заместители галогена оказывают общее дестабилизирующее влияние.
3. Характеристики специфических реакций замещения
|
Условия, обычно используемые для обсуждаемых здесь реакций ароматического замещения, повторяются в таблице справа. Электрофильная реакционная способность этих различных реагентов различается.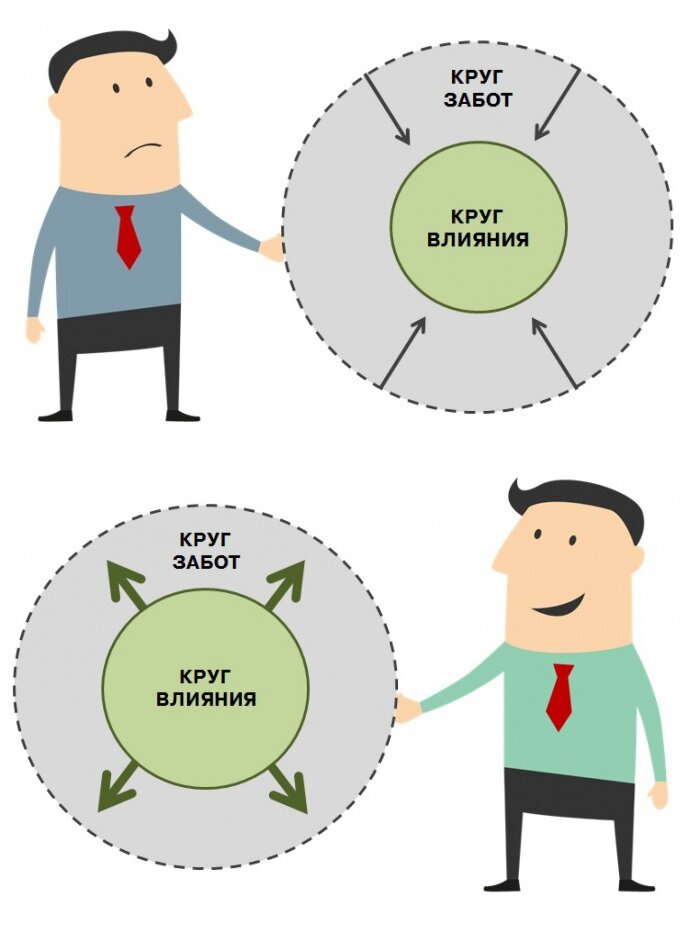 Мы находим, например, что нитрование нитробензола протекает гладко при 95 ºC, что дает мета-динитробензол, тогда как бромирование нитробензола (катализатор трехвалентного железа) требует температуры 140 ºC. Кроме того, как отмечалось ранее, толуол нитруется примерно в 25 раз быстрее, чем бензол, но хлорирование толуола происходит более чем в 500 раз быстрее, чем бензола. Отсюда можно заключить, что нитрующий реагент более реакционноспособен и менее селективен, чем галогенирующие реагенты.
Мы находим, например, что нитрование нитробензола протекает гладко при 95 ºC, что дает мета-динитробензол, тогда как бромирование нитробензола (катализатор трехвалентного железа) требует температуры 140 ºC. Кроме того, как отмечалось ранее, толуол нитруется примерно в 25 раз быстрее, чем бензол, но хлорирование толуола происходит более чем в 500 раз быстрее, чем бензола. Отсюда можно заключить, что нитрующий реагент более реакционноспособен и менее селективен, чем галогенирующие реагенты.
Как сульфирование, так и нитрование дают воду в качестве побочного продукта. Это не оказывает существенного влияния на реакцию нитрования (обратите внимание на присутствие серной кислоты в качестве дегидратирующего агента), но сульфирование обратимо и завершается добавлением триоксида серы, который превращает воду в серную кислоту. Обратимость реакции сульфирования иногда полезна для удаления этой функциональной группы.
Реагент Фриделя-Крафтса для ацилирования обычно состоит из ацилгалогенида или ангидрида, смешанного с катализатором на основе кислоты Льюиса, таким как AlCl 3 .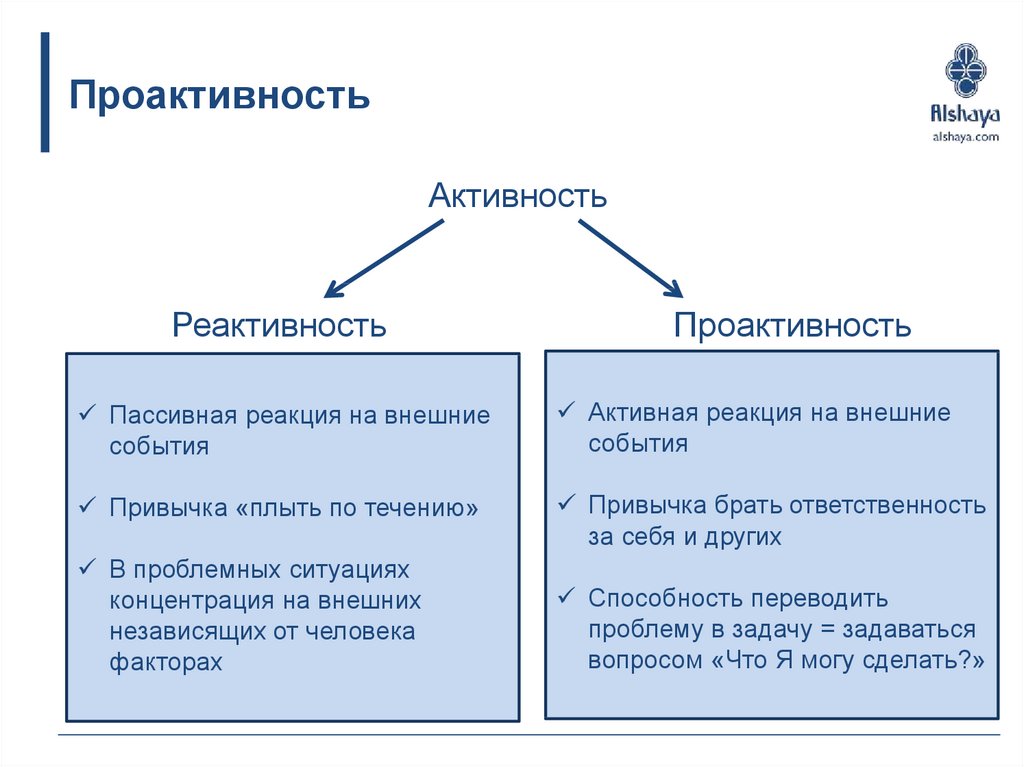 Это дает катион ацилия RC≡O (+) или родственные виды. Такие электрофилы не являются исключительно реакционноспособными, поэтому реакция ацилирования обычно ограничивается ароматическими системами, которые по крайней мере так же реакционноспособны, как хлорбензол. Сероуглерод часто используют в качестве растворителя, так как он нереакционноспособен и легко удаляется из продукта. Если субстрат представляет собой очень реакционноспособное производное бензола, такое как анизол, сложные эфиры карбоновых кислот или кислоты могут быть источником ацилирующего электрофила. Некоторые примеры реакций ацилирования Фриделя-Крафтса показаны на следующей диаграмме. Первый показывает, что в качестве реагентов можно использовать необычные ацилирующие агенты. Второй использует ангидридный ацилирующий реагент, а третий иллюстрирует легкость реакции анизола, как отмечалось ранее. Н 4 P 2 O 7 Используемый здесь реагент представляет собой ангидрид фосфорной кислоты, называемый пирофосфорной кислотой.
Это дает катион ацилия RC≡O (+) или родственные виды. Такие электрофилы не являются исключительно реакционноспособными, поэтому реакция ацилирования обычно ограничивается ароматическими системами, которые по крайней мере так же реакционноспособны, как хлорбензол. Сероуглерод часто используют в качестве растворителя, так как он нереакционноспособен и легко удаляется из продукта. Если субстрат представляет собой очень реакционноспособное производное бензола, такое как анизол, сложные эфиры карбоновых кислот или кислоты могут быть источником ацилирующего электрофила. Некоторые примеры реакций ацилирования Фриделя-Крафтса показаны на следующей диаграмме. Первый показывает, что в качестве реагентов можно использовать необычные ацилирующие агенты. Второй использует ангидридный ацилирующий реагент, а третий иллюстрирует легкость реакции анизола, как отмечалось ранее. Н 4 P 2 O 7 Используемый здесь реагент представляет собой ангидрид фосфорной кислоты, называемый пирофосфорной кислотой. Наконец, четвертый пример иллюстрирует несколько важных моментов. Поскольку нитрогруппа является мощным дезактивирующим заместителем, ацилирование нитробензола по Фриделю-Крафтсу не происходит ни при каких условиях. Однако присутствие второй сильно активирующей замещающей группы делает возможным ацилирование; место реакции является предпочтительным для обоих заместителей.
Наконец, четвертый пример иллюстрирует несколько важных моментов. Поскольку нитрогруппа является мощным дезактивирующим заместителем, ацилирование нитробензола по Фриделю-Крафтсу не происходит ни при каких условиях. Однако присутствие второй сильно активирующей замещающей группы делает возможным ацилирование; место реакции является предпочтительным для обоих заместителей.
Общей характеристикой реакций галогенирования, нитрования, сульфирования и ацилирования является то, что они вводят дезактивирующий заместитель в бензольное кольцо. В результате нам обычно не приходится беспокоиться об образовании продуктов дизамещения. Алкилирование Фриделя-Крафтса, с другой стороны, вводит активирующий заместитель (алкильную группу), поэтому может иметь место более одного замещения. Если бензол необходимо алкилировать, как в следующем синтезе трет-бутилбензола, моноалкилированному продукту способствует использование большого избытка этого реагента. Когда молярное отношение бензола к алкилгалогениду падает ниже 1:1, основным продуктом становится пара-ди-трет-бутилбензол.
C 6 H 6 (большой избыток)+(CH 3 ) 3 C -CL+ALCL 3 —> C 6 H 5 -C (CH . 3 ) 3 + HCl
Электрофилы карбокатионов, необходимые для алкилирования, могут быть получены из алкилгалогенидов (как указано выше), алкенов + сильной кислоты или спиртов + сильной кислоты. Поскольку 1º-карбокатионы склонны к перегруппировке, обычно невозможно ввести 1º-алкильные заместители большего размера, чем этил, путем алкилирования Фриделя-Крафтса. Например, реакция избытка бензола с 1-хлорпропаном и хлоридом алюминия дает хороший выход изопропилбензола (кумола).
Дополнительные примеры реакций алкилирования Фриделя-Крафтса показаны на следующей диаграмме.
Первый и третий примеры показывают, как алкены и спирты могут быть источником электрофильного реагента карбокатиона. Трифенилметильный катион, образующийся в третьем случае, относительно неактивен из-за обширной делокализации резонансного заряда и замещает только высокоактивированные ароматические кольца. Во втором примере показан интересный случай, когда в качестве алкилирующего агента используется полихлорреагент. Четырехкратный избыток четыреххлористого углерода используется, чтобы избежать триалкилирования этого реагента, процесса, который замедляется из-за стерических затруднений. Четвертый пример иллюстрирует плохую ориентационную селективность, часто встречающуюся в реакциях алкилирования активированных бензольных колец. Объемная трет-бутильная группа оказывается присоединенной к реакционноспособному мета -ксилоловое кольцо в наименее затрудненном участке. Это может не быть местом начального связывания, поскольку полиалкилбензолы перегруппировываются в условиях Фриделя-Крафтса ( параграф -дипропилбензол перегруппировывается в мета -дипропилбензол при нагревании с AlCl 3 ).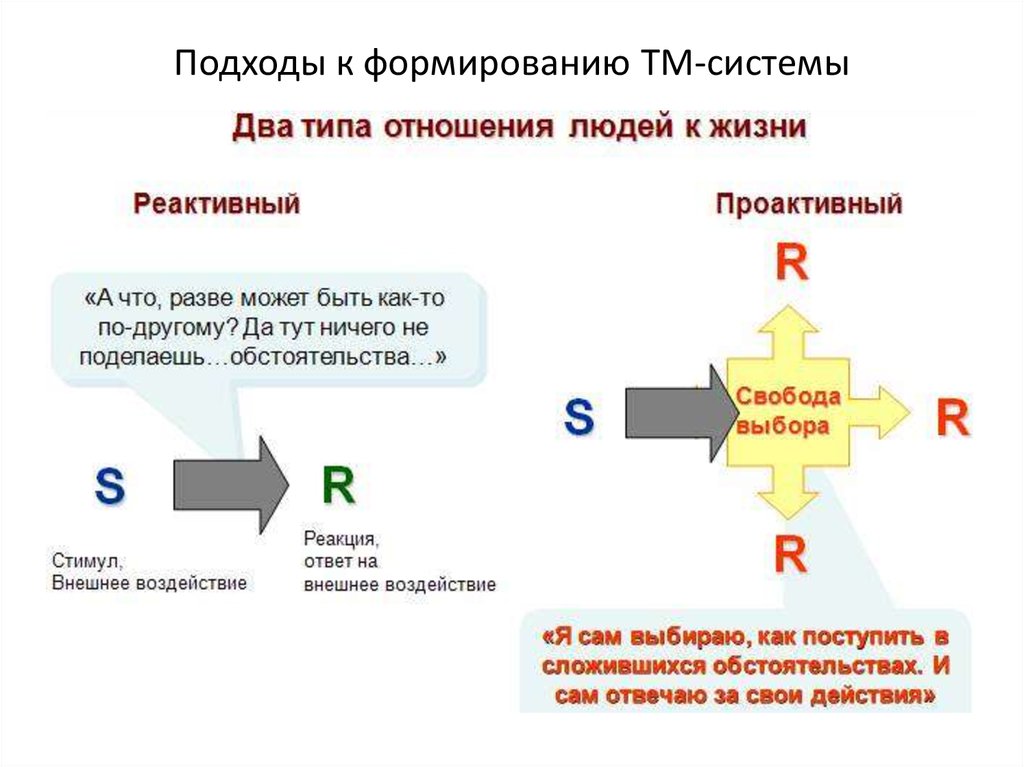
Практической проблемой при использовании реакций электрофильного ароматического замещения в синтезе является разделение смесей изомеров. Это особенно справедливо для случаев орто-паразамещения, при котором часто образуются значительные количества второстепенного изомера. Как правило, преобладают пара-изомеры, за исключением некоторых реакций толуола и родственных алкилбензолов. Разделению этих смесей способствует тот факт, что пара-изомеры имеют значительно более высокие температуры плавления, чем их орто-аналоги; следовательно, фракционная кристаллизация часто является эффективным методом выделения. Поскольку при метазамещении предпочтение отдается одному продукту, разделение следов изомеров обычно не представляет проблемы.
Некоторые заместители обеспечивают ортометаллирование ароматического кольца. |


 Продуманная рассылка отлично с этим справляется;
Продуманная рассылка отлично с этим справляется; Представьте, как бы выглядела в этом случае проактивная реакция и старайтесь в будущем придерживаться такого поведения.
Представьте, как бы выглядела в этом случае проактивная реакция и старайтесь в будущем придерживаться такого поведения. Постоянные дела. Задачи, требующие решения.
Постоянные дела. Задачи, требующие решения. И так в любых ситуациях. Чуть-чуть действий наперед, и результативность каждого дня начнет расти.
И так в любых ситуациях. Чуть-чуть действий наперед, и результативность каждого дня начнет расти.
 H 5 SO 3 H
H 5 SO 3 H 