Словообразовательный разбор слова. Как делать?
Бесплатный вводный урок по русскому языку
Записаться
Слова с одним корнем не зря называют родственными. В таких «семьях» одно слово происходит от другого и у всех есть общий предок — слово, от которого образовались прочие однокоренные. Предлагаем глубже погрузиться в этот процесс и понять, как происходит словообразование, какие слова называют производными и непроизводными, а также чем полезен словообразовательный разбор. В конце статьи вас ждут задания для самопроверки — они покажут, чему вы научились.
Что такое словообразовательный разбор
Словообразовательный разбор — это анализ слова, который помогает узнать, производное оно или непроизводное, а также с помощью чего и от какого слова с тем же корнем оно образовалось. Чтобы понять это, в словообразовательном разборе, как и в морфемном, мы разбираем слово по составу — выделяем приставку, корень, основу и суффикс.
Итак, первое, что нужно сделать, — это обратиться к смыслу слова, которое мы анализируем. Например, вредитель означает «тот, кто вредит». У слов вредитель и вредит одинаковые морфемы в основе, но в первом случае к ним добавляется еще и суффикс -тель. Делаем вывод, что данное слово вредитель образовано от ближайшего к нему родственного вредить.
В этом случае основу слова вредить называют производящей (ПЩ), потому что от нее образовалось новое слово, а основу слова вредитель — производной (ПН), т. к. она результат словообразования.
Слова с производной основой называются производными, а с производящей — производящими. Вместе производное и производящее слова образуют словообразовательную пару. В нашем случае это производное вредитель и производящее вредить.
Проверьте себя!
Найдите производящие слова для перечисленных далее и создайте словообразовательные пары: заслониться, убежать, приказ, монетный, увлекательный, преследователь, конный, побег, населенный, умножение, расслабиться, морозный.
Производные и непроизводные слова
Кроме производных, существуют и непроизводные слова — те, которые не образованы от основы другого слова с тем же корнем.
Чтобы разобраться в этом подробнее, вернемся к нашему примеру со словом вредить. Его тоже можно считать производным, потому что оно произошло от основы другого однокоренного слова — вред. В этом случае слова имеют один и тот же корень вред-, но у глагола вредить добавился суффикс —и-. Таким образом, слово вредить — производное, а вред — производящее. Но к последнему уже нельзя подобрать слово, от которого оно произошло. Значит, слово вред — непроизводное.
Кстати, все три слова образуют уже не пару, а цепочку словообразования, в которой можно проследить, как изменялась основа: вред → вредить → вредитель.
Проверьте себя!
Создайте словообразовательную цепочку, которая начиналась бы с непроизводного слова ключ..
Демо урок по русскому языку
Пройдите тест на вводном занятии и узнайте, какие темы отделяют вас от «пятёрки» по русскому.
Способы образования слов
Чтобы сделать полноценный словообразовательный разбор, нужно определить, каким способом от производящего слова образовалось производное. В русском языке существуют 8 таких словообразовательных способов. Рассмотрим их в таблице ниже.
Основные способы словообразования | ||
|---|---|---|
| Название | Как работает | Пример словообразовательной пары |
Приставочный | Приставка + ПЩ основа | Работать — проработать |
Суффиксальный | ПЩ основа + суффикс | Учить — учитель |
Приставочно-суффиксальный | Приставка + ПЩ основа + суффикс | Земля — приземленный |
Нулевая суффиксация | ПЩ основа + нулевой суффикс | Обогнать — обгон⍉ |
Сложение | 1. 2. Сложение ПЩ основ без соединительной гласной | 1. Гладкий + кожа = гладкокожий 2. Грусть + тоска = грусть-тоска |
Сложение с суффиксацией | 1. Сложение ПЩ основ + суффикс 2. Сложение ПЩ основ с соединительной гласной + суффикс | 1. Мимо + ходить = мимоходом 2. Вид + искать = видоискатель |
Аббревиация | Сложение ПЩ основ с их усечением | 1. Российская Федерация — РФ 2. Мотоцикл-велосипед — мопед |
Переход из одной части речи в другую | 1. 2. Причастие → существительное 3. Существительное → наречие | 1. Рабочие часы → рабочие в шахте 2. Убегающий человек → убегающий остановился 3. Восхищаться даром природы → даром не нужно |
Проверьте себя!
Прочтите слова ниже и определите, каким словообразовательным способом они появились.
Замминистра, сине-желтый, привлекательный, зажим, прикасаться, старшеклассник, преподаватель, ЦУМ, сантехник, теплоходный, перезимовать, прилунение, Волгоград.
Как правильно делать словообразовательный разбор
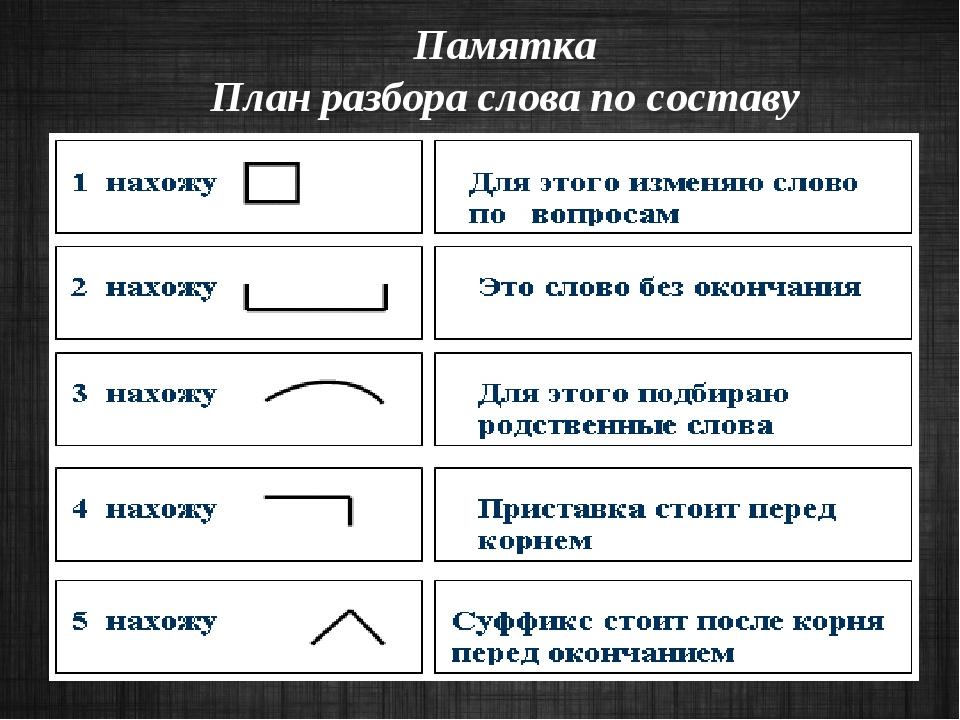
Словообразовательный разбор принято делать по такому алгоритму:
Ставим слово, которое хотим разобрать, в начальную форму.
Подбираем ближайшее родственное слово, чтобы создать словообразовательную пару.

Выделяем основы у каждого слова в паре.
-
Выделяем словообразовательные морфемы, с помощью которых образовалось производное слово.
Определяем способ словообразования и записываем его в скобках рядом со словообразовательной парой.
Теперь разберем несколько примеров, чтобы понять, как нужно делать словообразовательный разбор.
Проверьте себя
Настало время понять, что нового вы узнали из этой статьи. Ниже вас ждут 3 задания, которые проверят, насколько хорошо вы теперь анализируете структуру слов и определяете способ словообразования.
Задание 1
Замените названия ниже на аббревиатуры. Какой способ словообразования вы использовали?
Московский государственный медицинский университет, Организация Объединенных Наций, Соединенные Штаты Америки, Всероссийская проверочная работа, Единый государственный экзамен.
Задание 2
Прочтите список слов ниже и найдите среди них все непроизводные.
Брат, загон, приказ, мост, объезд, змей, бег, зелень, тишь, зверь, зонт.
Задание 3
Выполните словообразовательный разбор.
Разведка, прихожанин, юго-восточный, ответственный, замочная, невиданный, сад-огород, полноправный, забег, глушь.
Если словообразовательный разбор до сих пор вызывает сложности, стоит лучше изучить его на дополнительных занятиях. На курсе русского языка от Skysmart преподаватель расскажет все о том, как образуются слова, и поможет научиться словообразовательному разбору на нескучных заданиях. Познакомиться с платформой для онлайн-образования можно на вводном уроке — это бесплатно.
Шпаргалки по русскому для родителей
Все правила по русскому языку под рукой
Значение слов в словарях
Сложность и многогранность русского языка порой удивляют даже его носителей. Особенность заключается в отсутствии структурности. Ведь очень много вольностей допускается не только при построении предложений. Использование некоторых словоформ тоже имеет несколько вариаций.
Особенность заключается в отсутствии структурности. Ведь очень много вольностей допускается не только при построении предложений. Использование некоторых словоформ тоже имеет несколько вариаций.
Сложности и особенности работы со словом
В русском языке огромное количество допущений, которые нельзя встретить в других культурах. Ведь в речи часто используются не только литературные слова, которых свыше 150 тысяч. Но еще и диалектизмы. Так как в России много народов и культур, их более 250 тысяч. Неудивительно, что даже носителям языка иногда необходимо отыскать точные значения слов. Сделать это можно с помощью толковых словарей или специального сервиса WordMap.
Чем удобна такая площадка? Это понятный и простой словарь значений слов, использовать который предлагается в режиме онлайн. Сервис позволяет:
- узнать точное значение слова или идиомы;
- определить его корректное написание;
- понять, как правильно в нем ставить ударение.

Площадка предлагает ознакомиться с историей возникновения слова. Тут рассказывается, из какого языка или культуры оно пришло, когда и кем использовалось в речи.
Осуществляя поиск значения слов в словаре, важно понимать его суть. Ведь звуковая составляющая каждой лексической единицы в языке неразрывно связана с определенными предметами или явлениями. Вот почему при использовании сервиса не стоит ставить знак равенства между значением искомого слова и его понятием. Они связаны между собой, но не являются единым целым. К примеру, понятие слова «центр» можно определить как середину чего-либо. Однако конкретные значения могут указывать на внутреннюю часть комнаты, города, геометрической фигуры и т. д. Иногда речь идет о медицинской организации, математике или машиностроении. В многозначности и заключается сложность русского языка.
Поиск значений через WordMap
Для того, чтобы узнать, что значит слово, была проведена кропотливая работа. Ведь разные пособия и сборники могут давать разные значения одних и тех же лексических конструкций. Чтобы получить максимально полное представление о слове, стоит обратиться к сервису WordMap. В системе есть значения из наиболее популярных и авторитетных источников, включая словари:
Чтобы получить максимально полное представление о слове, стоит обратиться к сервису WordMap. В системе есть значения из наиболее популярных и авторитетных источников, включая словари:
- Ожегова;
- Даля;
- медицинского;
- городов;
- жаргонов;
- БСЭ и т. д.
Благодаря этому можно узнать не только все книжные, но и переносные значения лексической конструкции.
Только что искали:
премудрую 4 секунды назад
митяреа 5 секунд назад
щокибрс 7 секунд назад
делла 7 секунд назад
пашножи 8 секунд назад
стеьжонн 8 секунд назад
лубпаа 8 секунд назад
аара 8 секунд назад
чрдекжуо 8 секунд назад
еретика 8 секунд назад
отпускница 9 секунд назад
жилил 20 секунд назад
тирфаг 20 секунд назад
тюрен 21 секунда назад
таосрф 21 секунда назад
Плотность и процентные составы — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 350
Что тяжелее, килограмм перьев или килограмм кирпичей? Хотя многие люди скажут, что килограмм кирпичей тяжелее, на самом деле они весят одинаково! Однако многие люди захвачены понятием плотности, что заставляет их неправильно отвечать на вопрос. Килограмм перьев явно занимает больше места, но это потому, что он менее «плотный». Но что такое плотность и как ее определить?
Килограмм перьев явно занимает больше места, но это потому, что он менее «плотный». Но что такое плотность и как ее определить?
Введение
Плотность (\(\rho\)) — это физическое свойство, которое можно найти путем деления массы объекта на его объем. Независимо от размера выборки плотность всегда постоянна. Например, плотность чистого образца вольфрама всегда составляет 19,25 грамма на кубический сантиметр. Это означает, что независимо от того, есть ли у вас один грамм или один килограмм образца, плотность никогда не изменится. Уравнение выглядит следующим образом:
\[ Плотность = \dfrac{Масса}{Объем} \]
или просто
\[\rho = \dfrac{m}{v} \label{dens}\]
На основании уравнения \(\ref{dens}\) становится ясно, что плотность может варьироваться и изменяется от элемента к элементу и вещество к веществу из-за различий в отношении массы и объема. Давайте разберем его еще на один шаг. Что такое масса и объем? Мы не можем понять плотность, пока не знаем ее части: массу и объем. Следующие два раздела познакомят вас со всей необходимой информацией об объеме и массе, чтобы правильно решать и манипулировать уравнением плотности.
Следующие два раздела познакомят вас со всей необходимой информацией об объеме и массе, чтобы правильно решать и манипулировать уравнением плотности.
Масса
Масса относится к количеству материи в объекте. Единицей массы в СИ является килограмм (кг), хотя граммы (г) обычно используются в лаборатории для измерения меньших величин. Часто люди путают вес с массой. Вес касается силы, действующей на объект в зависимости от массы и гравитации. Это можно записать как
\[\text{Вес} = \text{масса} \times \text{гравитация}\]
\(Вес = {м}{г}\)
Следовательно, изменения веса из-за изменения гравитации и ускорения. Например, масса куба весом 1 кг останется равной 1 кг, находится ли он на вершине горы, на дне моря или на Луне, но его вес будет другим. Еще одно важное различие между массой и весом заключается в том, как они измеряются. Вес измеряется весами, а масса измеряется весами. Точно так же, как люди путают массу и вес, они также путают весы и противовесы. Весы противодействуют действию гравитации, а весы учитывают ее. В лаборатории есть два типа весов: электронные и ручные. С ручными весами вы находите неизвестную массу объекта, регулируя или сравнивая известные массы, пока не будет достигнуто равновесие.
Весы противодействуют действию гравитации, а весы учитывают ее. В лаборатории есть два типа весов: электронные и ручные. С ручными весами вы находите неизвестную массу объекта, регулируя или сравнивая известные массы, пока не будет достигнуто равновесие.
Объем
Объем описывает количество трехмерного пространства, которое занимает объект. Единицей объема в СИ является кубический метр (м 3 ), но миллилитры (мл), кубические сантиметры (см 3 ) и литры (л) более распространены в лаборатории. Существует множество уравнений для нахождения объема. Вот лишь некоторые из простых:
Объем = (длина) 3 или (длина)(ширина)(высота) или (площадь основания)(высота)
Плотность: дальнейшее исследование
Мы знаем все компоненты плотности, так что давайте более подробно рассмотрим саму плотность. Единицей, наиболее широко используемой для выражения плотности, является г/см 3 или г/мл, хотя технически единицей СИ для плотности является кг/м 3 . Граммы на сантиметр в кубе эквивалентны граммам на миллилитр (г/см
Граммы на сантиметр в кубе эквивалентны граммам на миллилитр (г/см
Иногда вам нужно преобразовать единицы измерения, чтобы получить правильные единицы плотности, например, мг в г или 3 в см 3 .
Плотность может использоваться для идентификации неизвестного элемента. Конечно, вы должны знать плотность элемента по отношению к другим элементам. Ниже приведена таблица, в которой перечислены плотности нескольких элементов из Периодической таблицы при стандартных условиях температуры и давления, или STP, соответствующие температуре 273 К (0° Цельсия) и давлению в 1 атмосферу. 9{-4})\) при 0 °С и 1 атм. давление
 13
13 Как видно из таблицы, самым плотным элементом является осмий (Os) с плотностью 22,6 г/см 3 . Наименее плотным элементом является водород (H) с плотностью 0,09 г/см 3 .
Наименее плотным элементом является водород (H) с плотностью 0,09 г/см 3 .
Плотность и температура
Плотность обычно уменьшается с повышением температуры и также увеличивается с понижением температуры. Это связано с тем, что объем зависит от температуры. Объем увеличивается с повышением температуры. Если вам интересно, почему плотность чистого вещества может меняться в зависимости от температуры, загляните на страницу ChemWiki, посвященную взаимодействиям Ван-дер-Вааль. Ниже приведена таблица, показывающая плотность чистой воды при разных температурах.
| Температура (C) | Плотность (г/см 3 ) |
|---|---|
| 100 | 0,9584 |
| 80 | 0,9718 |
| 60 | 0,9832 |
| 40 | 0,9922 |
| 30 | 0,9957 |
| 25 | 0,997 |
| 22 | 0,9978 |
| 20 | 0,9982 |
| 15 | 0,9991 |
| 10 | 0,9997 |
| 4 | 1. 000 000 |
| 0 (жидкость) | .9998 |
| 0 (сплошной) | 0,9150 |
Как видно из таблицы \(\PageIndex{2}\), плотность воды уменьшается с повышением температуры. Жидкая вода также является исключением из этого правила при температуре от 0 до 4 градусов Цельсия, когда ее плотность увеличивается, а не уменьшается, как ожидалось. Глядя на таблицу, вы также можете увидеть, что лед менее плотный, чем вода. Это необычно, поскольку твердые вещества обычно более плотные, чем их жидкие аналоги. Лед менее плотный, чем вода из-за водородных связей. В молекуле воды водородные связи прочные и компактные. По мере того как вода замерзает в шестиугольные кристаллы льда, эти водородные связи отдаляются друг от друга, и объем увеличивается. С этим увеличением объема происходит уменьшение плотности. Это объясняет, почему лед всплывает на поверхность чашки с водой: лед менее плотный.
Несмотря на то, что правило плотности и температуры имеет свои исключения, оно все же полезно. Например, он объясняет, как работают воздушные шары.
Плотность и давление
Плотность увеличивается с увеличением давления, поскольку объем уменьшается с увеличением давления. А поскольку плотность = масса/объем, то чем меньше объем, тем выше плотность. Вот почему все значения плотности в периодической таблице записываются в STP, как указано в разделе «Плотность и периодическая таблица». Уменьшение объема по отношению к давлению объясняется законом Бойля: \(P_1V_1 = P_2V_2\), где P = давление, а V = объем. Эта идея поясняется на рисунке ниже. Подробнее о законе Бойля, а также о других газовых законах можно узнать здесь.
Принцип Архимеда
Греческий ученый Архимед сделал важное открытие в 212 г. до н.э. История гласит, что Архимеда попросили выяснить для короля, не обманывает ли его ювелир, заменяя золото для короны серебром, более дешевым металлом. Архимед не знал, как найти объем объекта неправильной формы, такого как корона, хотя знал, что может различать элементы по их плотности. Размышляя над этой загадкой в ванне, Архимед понял, что, когда он вошел в ванну, вода поднялась. Затем он понял, что может использовать аналогичный процесс для определения плотности короны! Затем он якобы бегал по улицам голым, крича «Эврика», что означает «Я нашел это!» на латыни.
Архимед не знал, как найти объем объекта неправильной формы, такого как корона, хотя знал, что может различать элементы по их плотности. Размышляя над этой загадкой в ванне, Архимед понял, что, когда он вошел в ванну, вода поднялась. Затем он понял, что может использовать аналогичный процесс для определения плотности короны! Затем он якобы бегал по улицам голым, крича «Эврика», что означает «Я нашел это!» на латыни.
Затем Архимед проверил корону царя, взяв настоящую золотую корону равной массы и сравнив плотность двух корон. Королевская корона вытеснила больше воды, чем золотая корона той же массы, а это означает, что королевская корона имела больший объем и, следовательно, меньшую плотность, чем настоящая золотая корона. Таким образом, «золотая» корона короля не была сделана из чистого золота. Конечно, эта история сегодня оспаривается, потому что Архимед не был точен во всех своих измерениях, что затруднило бы точное определение различий между двумя коронами.
Принцип Архимеда гласит, что если объект имеет большую плотность, чем жидкость, в которую он помещен, он будет тонуть и вытеснять объем жидкости, равный его собственному. Если он имеет меньшую плотность, то будет всплывать и вытеснять массу жидкости, равную своей собственной. Если плотность одинакова, он не будет тонуть или всплывать. Этот принцип также объясняет, почему воздушные шары, наполненные гелием, всплывают. Воздушные шары, как мы узнали из раздела о плотности и температуре, плавают, потому что они менее плотны, чем окружающий воздух. Гелий менее плотный, чем атмосферный воздух, поэтому он поднимается вверх. Принцип Архимеда также можно использовать для объяснения того, почему лодки плавают. Лодки, включая все воздушное пространство внутри их корпусов, имеют гораздо меньшую плотность, чем вода. Лодки из стали могут плавать, потому что они перемещают свою массу в воде, не погружаясь полностью.
Если он имеет меньшую плотность, то будет всплывать и вытеснять массу жидкости, равную своей собственной. Если плотность одинакова, он не будет тонуть или всплывать. Этот принцип также объясняет, почему воздушные шары, наполненные гелием, всплывают. Воздушные шары, как мы узнали из раздела о плотности и температуре, плавают, потому что они менее плотны, чем окружающий воздух. Гелий менее плотный, чем атмосферный воздух, поэтому он поднимается вверх. Принцип Архимеда также можно использовать для объяснения того, почему лодки плавают. Лодки, включая все воздушное пространство внутри их корпусов, имеют гораздо меньшую плотность, чем вода. Лодки из стали могут плавать, потому что они перемещают свою массу в воде, не погружаясь полностью.
В приведенной ниже таблице \(\PageIndex{3}\) приведены значения плотности некоторых жидкостей для наглядности.
| Жидкость | Плотность в кг/м 3 | Плотность в г/см 3 |
|---|---|---|
| 2-метоксиэтанол | 964,60 | 0,9646 |
| Уксусная кислота | 1049. | 1,049 |
| Ацетон | 789,86 | 0,7898 |
| Спирт этиловый | 785.06 | 0,7851 |
| Спирт метиловый | 786,51 | 0,7865 |
| Аммиак | 823,35 | 0,8234 |
| Бензол | 873,81 | 0,8738 |
| Вода чистая | 1000. | 1.000 |
Процентный состав
Процентный состав очень прост. Процентный состав говорит вам по массе, какой процент каждого элемента присутствует в соединении. Химическое соединение представляет собой комбинацию двух или более элементов. Если вы изучаете химическое соединение, вы можете захотеть найти процентное содержание определенного элемента в этом химическом соединении. Уравнение для процентного состава: (масса элемента/молекулярная масса) x 100,9.0024
Этапы расчета процентного состава элементов в соединении
- Найдите молярную массу всех элементов в соединении в граммах на моль.
- Найдите молекулярную массу всего соединения.
- Разделите молярную массу компонента на полную молекулярную массу.
- Теперь у вас будет число от 0 до 1. Умножьте его на 100%, чтобы получить состав в процентах.
Советы по решению:
- Процентный состав всех элементов в соединениях должен составлять в сумме 100%.
 В бинарном соединении вы можете найти % первого элемента, затем сделать 100%-(% первого элемента), чтобы получить (% второго элемента)
В бинарном соединении вы можете найти % первого элемента, затем сделать 100%-(% первого элемента), чтобы получить (% второго элемента) - Если вы используете калькулятор, вы можете сохранить общую молярную массу в переменной, такой как «A». Это ускорит расчеты и уменьшит количество ошибок.
Пример \(\PageIndex{1}\): Пентахлорид фосфора
Каково процентное содержание фосфора и хлора в \(PCl_5\)?
Раствор
Найдите молярную массу всех элементов соединения в граммах на моль.
- \(P\): \(1 \х30,975\,г/моль = 30,75\, г/моль\)
- \(Cl\): \(5 \х35,453\, г/моль = 177,265\, г/моль\)
Найдите молекулярную массу всего соединения.
- \(PCl_5\): \(1 \х30,975\,г/моль + 5\х35,453\, г/моль = 208,239\, г/моль\)
Разделите молярную массу компонента на полную молекулярную массу.
- \(P\): \(\dfrac{30,75\, г/моль}{208,239\, г/моль} \х100\% = 14,87\%\)
- \(Cl\): \(\dfrac{177,265\, г/моль}{208,239\, г/моль} \х100\% = 85,13 \%\)
Следовательно, в \(PCl_5\) содержится 14,87% фосфора и 85,13% хлора по массе.
Пример \(\PageIndex{2}\): HCl
Каково процентное содержание каждого элемента в соляной кислоте (HCl).
Решение
Сначала найдите молярную массу водорода.
\[H = 1,00794 \,g\]
Теперь найдите молекулярную массу молекулы HCl:
\[1,00794\,g + 35,4527\,g = 36,46064\,g\]
Выполните шаги 3 и 4:
\[ \left(\dfrac{1,00794\,g}{36,46064\,g}\right) \times 100\% = 2,76\% \]
Теперь просто вычтите, чтобы найти процент по массе хлора в соединении:
\[100\%-2,76\% = 97,24\%\]
Следовательно, \(HCl\) состоит из 2,76% водорода и 97,24% хлора по массе.
Процентный состав в повседневной жизни
Процентный состав играет важную роль в повседневной жизни. Это больше, чем просто количество хлора в вашем бассейне, потому что это касается всего: от денег в вашем кармане до вашего здоровья и образа жизни. Следующие два раздела описывают процентный состав применительно к вам.
Этикетки с пищевой ценностью
Этикетка с пищевой ценностью, которую можно найти на упаковке каждого кусочка обработанных пищевых продуктов, продаваемых в местном продуктовом магазине, использует идею процентного состава. На всех этикетках пищевых продуктов известный размер порции разбит на пять категорий: общий жир, холестерин, натрий, общее количество углеводов и белок. Эти категории разбиты на дополнительные подкатегории, включая насыщенные жиры и пищевые волокна. Масса для каждой категории, кроме белка, затем преобразуется в процент от дневной нормы. Только две подкатегории, насыщенные жиры и пищевые волокна, преобразуются в проценты от дневной нормы. Дневная норма основана на массе каждой категории, рекомендуемой в день на человека при диете в 2000 калорий. Масса белка не конвертируется в проценты, потому что это не рекомендуемая дневная норма белка. Ниже приведена фотография, иллюстрирующая эти идеи.
На всех этикетках пищевых продуктов известный размер порции разбит на пять категорий: общий жир, холестерин, натрий, общее количество углеводов и белок. Эти категории разбиты на дополнительные подкатегории, включая насыщенные жиры и пищевые волокна. Масса для каждой категории, кроме белка, затем преобразуется в процент от дневной нормы. Только две подкатегории, насыщенные жиры и пищевые волокна, преобразуются в проценты от дневной нормы. Дневная норма основана на массе каждой категории, рекомендуемой в день на человека при диете в 2000 калорий. Масса белка не конвертируется в проценты, потому что это не рекомендуемая дневная норма белка. Ниже приведена фотография, иллюстрирующая эти идеи.
Например, если вы хотите узнать процент по массе дневной нормы натрия, которую вы едите, когда съедаете одну порцию продукта с этой этикеткой пищевой ценности, перейдите в категорию с пометкой «Натрий». Посмотрите на ту же строку и прочитайте написанный процент. Если вы съедите одну порцию этой пищи, то вы употребите около 9% рекомендуемой дневной нормы натрия. Чтобы найти массовый процент жира во всей пище, вы можете разделить 3,5 грамма на 15 граммов и увидеть, что эта закуска содержит 23,33% жира.
Чтобы найти массовый процент жира во всей пище, вы можете разделить 3,5 грамма на 15 граммов и увидеть, что эта закуска содержит 23,33% жира.
Пенни: Счастливая медная монета
Пенни следует называть «счастливая медная монета с покрытием «. Пенни не делали из твердой меди с 1857 года. После 1857 года правительство США начало добавлять в смесь другие более дешевые металлы. Пенни, будучи всего лишь одним центом, буквально не стоит своего веса в меди. Люди могли плавить медные пенни и продавать медь дороже, чем стоили эти пенни. После 1857 года никель смешивали с более дорогой медью. После 1864 года пенни стали делать из бронзы. Бронза 95% меди и 5% цинка и олова. В течение одного 1943 года в пенни не было меди из-за расходов на Вторую мировую войну. Это была просто оцинкованная сталь. С 1943 по 1982 год у пенни были периоды, когда он был латунным или бронзовым.
Сегодня пенни в Америке состоит из 2,5% меди и 97,5% цинка. Медь покрывает внешнюю часть пенни, а внутренняя часть покрыта цинком. Для сравнения, пенни в Канаде состоит из 94% стали, 1,5% никеля и 4,5% меди.
Для сравнения, пенни в Канаде состоит из 94% стали, 1,5% никеля и 4,5% меди.
Процентный состав монетки может реально повлиять на здоровье, особенно на здоровье маленьких детей и домашних животных. Поскольку новые пенни сделаны в основном из цинка, а не из меди, они представляют опасность для здоровья ребенка при проглатывании. Цинк очень чувствителен к кислоте. Если тонкое медное покрытие поцарапать и соляная кислота, присутствующая в желудке, вступит в контакт с цинковым сердечником, это может вызвать язву, анемию, повреждение почек и печени, а в тяжелых случаях даже смерть. Три важных фактора при проглатывании пенни — это время, pH желудка и количество проглоченных пенни. Конечно, чем больше копеек проглочено, тем больше опасность передозировки цинка. Чем кислее среда, тем больше цинка высвобождается за меньшее время. Затем этот цинк поглощается и отправляется в печень, где начинает наносить ущерб. В такой ситуации время имеет решающее значение. Чем быстрее удаляется копейка, тем меньше цинка усваивается. Если пенни или пенни не удалить, может произойти отказ органов и смерть.
Если пенни или пенни не удалить, может произойти отказ органов и смерть.
Ниже приведено изображение поцарапанной монеты до и после того, как она была погружена в лимонный сок. Лимонный сок имеет аналогичный pH 1,5-2,5 по сравнению с нормальным человеческим желудком после употребления пищи. Прошедшее время: 36 часов.
Как видите, лимонный сок практически не повреждает медь. Вот почему пенни, изготовленные до 1982 года, в основном из меди (кроме пенни 1943 года), относительно безопасно глотать. Скорее всего, они пройдут через пищеварительную систему естественным путем, прежде чем можно будет нанести какой-либо ущерб. Тем не менее, ясно, что цинк частично растворился, хотя он находился в лимонном соке лишь ограниченное время. Поэтому процентный состав поста 1982 пенни опасны для вашего здоровья и здоровья ваших домашних животных при попадании внутрь.
Резюме
Плотность и процентный состав являются важными понятиями в химии. Каждый из них имеет основные компоненты, а также широкие области применения. Компонентами плотности являются: масса и объем, оба из которых могут быть более запутанными, чем на первый взгляд. Приложением понятия плотности является определение объема неправильной формы по известной массе и плотности. Определение процентного состава требует знания массы всего объекта или молекулы и массы ее компонентов. В лаборатории плотность может использоваться для идентификации элемента, а процентный состав используется для определения количества по массе каждого элемента, присутствующего в химическом соединении. В повседневной жизни плотность объясняет все: от того, почему лодки плавают, до того, почему пузырьки воздуха пытаются вырваться из газировки. Это даже влияет на ваше здоровье, потому что плотность костей очень важна. Точно так же процентный состав обычно используется для изготовления кормов для животных и таких соединений, как пищевая сода, которую можно найти на вашей кухне.
Компонентами плотности являются: масса и объем, оба из которых могут быть более запутанными, чем на первый взгляд. Приложением понятия плотности является определение объема неправильной формы по известной массе и плотности. Определение процентного состава требует знания массы всего объекта или молекулы и массы ее компонентов. В лаборатории плотность может использоваться для идентификации элемента, а процентный состав используется для определения количества по массе каждого элемента, присутствующего в химическом соединении. В повседневной жизни плотность объясняет все: от того, почему лодки плавают, до того, почему пузырьки воздуха пытаются вырваться из газировки. Это даже влияет на ваше здоровье, потому что плотность костей очень важна. Точно так же процентный состав обычно используется для изготовления кормов для животных и таких соединений, как пищевая сода, которую можно найти на вашей кухне.
Задачи на плотность
Сначала эти задачи должны быть легкими, а затем постепенно усложняться. Если не указано иное, ответы должны быть указаны в г/мл или в эквиваленте г/см 3 .
Если не указано иное, ответы должны быть указаны в г/мл или в эквиваленте г/см 3 .
- Если у вас есть образец уксусной кислоты объемом 2,130 мл и массой 0,002234 кг, какова плотность?
- Рассчитайте плотность образца этилового спирта объемом 0,03020 л и массой 23,71002 г.
- Найдите плотность образца объемом 36,5 л и массой 10,0 кг.
- Найдите объем в мл тела плотностью 10,2 г/л и массой 30,0 кг.
- Рассчитайте массу в граммах объекта объемом 23,5 мл и плотностью 10,0 г/л.
- Рассчитайте плотность прямоугольной призмы из металла. Размеры призмы: 5 см на 4 см на 5 см. Металл имеет массу 50 грамм.
- Найдите плотность неизвестной жидкости в стакане. Масса стакана без жидкости 165 г. С неизвестной жидкостью общая масса равна 309грамм. Объем неизвестного составляет 125 мл.
- Определите плотность неизвестного вещества в г/л, используя следующую информацию.
 55-галлонная ванна весит 137,5 фунтов, когда она пуста, и 500,0 фунтов, когда она наполнена неизвестным.
55-галлонная ванна весит 137,5 фунтов, когда она пуста, и 500,0 фунтов, когда она наполнена неизвестным. - Кольцо имеет массу 5,00 г и объем 0,476 мл. Это чистое серебро?
- Какова плотность твердого тела на изображении, если его масса равна 40 г? Пусть ваш ответ будет состоять из 3-х значащих цифр.
11) Ниже представлена модель пирамиды из неизвестного вещества, найденной при археологических раскопках. Он слишком велик, чтобы найти его объем, погрузив его в воду. Кроме того, ученые отказываются снимать кусок для проверки, потому что эта пирамида является частью истории. Его высота составляет 150,0 м. Длина его основания 75,0 м, а ширина 50,0 м. Масса этой пирамиды 5,50х10 5 кг. Какова плотность?
Решения проблемы плотности
- 1,049 г/мл
- 0,7851 г/мл
- 0,274 г/мл
- 2,94 x 10 6 мл
- 0,3,27 кг
- 0,5 г/см 3
- 1,15 г/мл
- 790 г/л
- Да
- 0,195 г/см 3
- 29,3 г/см 3
Задачи на процентную композицию
Эти задачи будут следовать той же схеме сложности, что и задачи на плотность.
- Рассчитайте массовые проценты каждого элемента во фториде цезия (CsF).
- Рассчитайте массовые проценты каждого элемента, присутствующего в четыреххлористом углероде (CCl 4 )
- Раствор соли и воды содержит 33,0% соли по массе и имеет плотность 1,50 г/мл. Какая масса соли в граммах содержится в 5,00 л этого раствора?
- Раствор воды и HCl содержит 25% HCl по массе. Плотность раствора 1,05 г/мл. Если вам нужно 1,7 г HCl для реакции, какой объем этого раствора вы будете использовать?
- Раствор, содержащий 42 % NaOH по массе, имеет плотность 1,30 г/мл. Какая масса в килограммах NaOH содержится в 6,00 л этого раствора?
Процент решения проблемы состава
- CsF состоит из 87,5% Cs и 12,5% F по массе
- CCl 4 содержит 92,2% Cl и 7,8% C по массе
- 2480 г
- 6,5 мл
- 2,38 кг
Ссылки
- АВТОР, АРКИМЕД и Томас Литтл.
 Произведения Архимеда. Courier Dover Publications, 2002.
Произведения Архимеда. Courier Dover Publications, 2002. - Чанде, Д. и Т. Фишер (2003). «Есть пенни? Нужен пенни? Исключение одноцентовой монеты из обращения». Canadian Public Policy/Analyse de Politiques 29 (4): 511-517.
Джефферсон, Т. (1999). «Мысль за ваши гроши». JAMA 281 (2): 122.
- Петруччи, Ральф, Уильям Харвуд и Джеффри Херринг. Принципы и современное применение. девятый. Нью-Джерси: Peason Eduation, 2007. .
Rauch, F., H. Plotkin, et al. (2003). «Костная масса, размер и плотность у детей и подростков с несовершенным остеогенезом: эффект внутривенной терапии памидронатом». Journal of Bone and Mineral Research 18 : 610-614.
Richardson, J., S. Gwaltney-Brant, et al. (2002). «Цинковый токсикоз от проглатывания пенни у собак». Vet Med 97 (2): 96-99.
Тейт, Дж.
 «Открытия Архимеда: пристальный взгляд».
«Открытия Архимеда: пристальный взгляд».
Density and Percent Compositions распространяется по незаявленной лицензии, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Теги
Формула процентного состава — Изучите формулу для расчета процентного состава
В формуле процентного состава мы узнаем о расчете процентного состава соединения, т. е. каково соотношение количества присутствующих элементов в процентах. Он в основном используется для определения процентного состава различных соединений в области химии. Процентный состав дает нам подробную информацию о количестве каждого элемента, присутствующего в соединении, в процентах по массе. Формула процентного состава помогает нам рассчитать массовый процент каждого элемента в отдельности. Рассмотрим подробнее формулу процентного состава.
е. каково соотношение количества присутствующих элементов в процентах. Он в основном используется для определения процентного состава различных соединений в области химии. Процентный состав дает нам подробную информацию о количестве каждого элемента, присутствующего в соединении, в процентах по массе. Формула процентного состава помогает нам рассчитать массовый процент каждого элемента в отдельности. Рассмотрим подробнее формулу процентного состава.
Разберитесь со сложными концепциями с помощью простых визуальных средств.
Математика больше не будет сложным предметом, особенно когда вы понимаете концепции с помощью визуализаций с помощью Cuemath.
Заказать бесплатный пробный урок
Процентный состав элемента рассчитывается путем деления молярной массы этого элемента на общую молекулярную массу соединения. Формула процентного состава выражается следующим образом:
\(\%C_E = \dfrac{g_E}{g_T} \times 100\)
где,
- \(\%C_E\) = Процентный состав элемента
- \(g_E\) = масса элемента в одном моле соединения .
- \(g_T\) = Молярная масса соединения

Шаги для расчета формулы состава в процентах
- Найдите молярную массу всех отдельных соединений.
- Найдите молекулярную массу соединения.
- Разделите молярную массу (конкретного элемента) на молекулярную массу соединения.
- Умножьте результат на 100, чтобы преобразовать его в проценты.
Рассмотрим применение формулы процентного состава на примере решения.
Пример 1. Рассчитайте процентный состав каждого элемента в соляной кислоте (HCl), используя формулу процентного состава.
Раствор :
HCl состоит из водорода (H) и хлора (Cl)
Молярная масса H = \(г_{(водород)}\) = 1 г
Молярная масса Cl = \({g_{(Хлор)}}\) = 35,5 г
Молекулярная масса HCl = \({g_T}\) = 1 + 35,5 = 36,6 г
Используя формулу процентного состава,
Процентный состав водорода:
%\(C_{(водород)}\) = \(g_{(водород)}\) / \(g_T\) × 100
= (1/36,5) × 100
= 2,74%
Процентный состав хлора:
%\(C_{(водород)}\) = 100% — %\(C_{(водород)}\)
= 100% — 2,74% = 97,26%
Ответ: Таким образом, процентный состав водорода и хлора составляет 2,74% и 97,26% соответственно.

 Сложение ПЩ основ + соединительная гласная
Сложение ПЩ основ + соединительная гласная Прилагательное → существительное
Прилагательное → существительное

 10
10 00
00 В бинарном соединении вы можете найти % первого элемента, затем сделать 100%-(% первого элемента), чтобы получить (% второго элемента)
В бинарном соединении вы можете найти % первого элемента, затем сделать 100%-(% первого элемента), чтобы получить (% второго элемента) 55-галлонная ванна весит 137,5 фунтов, когда она пуста, и 500,0 фунтов, когда она наполнена неизвестным.
55-галлонная ванна весит 137,5 фунтов, когда она пуста, и 500,0 фунтов, когда она наполнена неизвестным. Произведения Архимеда. Courier Dover Publications, 2002.
Произведения Архимеда. Courier Dover Publications, 2002. «Открытия Архимеда: пристальный взгляд».
«Открытия Архимеда: пристальный взгляд».